| Купить детское автокресло тут Описание купить детское автокресло тут. mommart.ru |
Кислород, его общая характеристика и нахождение в природе. Получение кислорода
 Скачать 56.44 Kb. Скачать 56.44 Kb.
|
| Тема: Кислород, его общая характеристика и нахождение в природе. Получение кислорода. Цель: знать: а) нахождение кислорода в природе, его роль в жизни организмов планеты; б) способы получения кислорода в лаборатории и промышленности; в) работу газометра; г) что такое катализаторы. Уметь: а) давать характеристику кислорода как химического элемента и как простого вещества; б) уметь собирать кислород двумя способами, собирать прибор для получения газов. Оборудование: газометр с кислородом, 2 прибора для получения газов, KMnO4крист., ватка, горелки, спички, кристаллизатор с водой, пустые стаканы с песком на дне, лучина, MnO2, ложечка, гидропирит, держатель, пробирки, круговая диаграмма «Распространение элементов в природе», «План характеристика химического элемента и вещества», портрет А. Лавуазье, перфокарты для самостоятельной работы. Форма урока: Комбинированный урок Методы: беседа с демонстрацией, самостоятельная работа. Ход урока 1. Организационный момент. 2. Изучение нового материала. Сегодня мы с вами, ребята, начинаем знакомство с одним из самых замечательных химическим элементом – кислородом. Вы уже много можете сказать о нем сами, т. к. знакомились с кислородом в курсе природоведения, ботаники, есть о нем у вас сведения из повседневной жизни и из уроков химии. Что же вы знаете о кислороде? Давайте проведем химическую дуэль, чтобы определить эти знания. Химическая дуэль: дуэлянты (2 ученика) по очереди называют известные им сведения о кислороде, секундант отмечает на доске правильность ответов. Учитель: После химической дуэли сообщаю, что сведения о кислороде неполные, что обучающиеся должны уметь давать характеристику химическим элементам по определенному плану. План характеристика элемента. 1. Химический знак. 2. Относительная атомная масса. 3. Валентность. 4. Распространение элемента в природе. План характеристики простого вещества. 1. Химическая формула. 2. Относительная молекулярная масса. 3. Нахождение в природе. 4. Способы получения в лаборатории и промышленности. 5. Физические свойства. 6. Химические свойства. 7. Применение. Изложение 1) Характеристика по плану (как элемент): 1. O; 2. Ar (O)=16; II 3. О; 4. В природе 49% - круговая диаграмма как элемент в сложных веществах 2)Как химического вещества: 1. О2; 2. Mr(O2)=16*2=32; Mr(O2)=32 г/моль Не много тяжелее воздуха 3. Нахождение в природе: как простое вещество в составе воздуха, растворенный в воде, в белках, жирах, углеводах. Учитель: Кислород – самый распространенный элемент на нашей планете. Как же его открыли? Послушайте сообщение. Учитель: Таким образом, мы подошли к способам получения кислорода в лаборатории: Разложение оксида ртути осуществил в 1774 г Джозеф Пристли. С этой реакцией мы знакомились в теме: «молекулы и атомы»
При каких условиях идет эта химическая реакция? - Постоянный электрический ток. 3. 2KMnO4-K2MnO4 +MnO2 +O2 Этот способ получения кислорода мы рассмотрим подробнее, именно так вы будите получать О2 на практической работе. Вы видите прибор для получения газов, в большой пробирке – перманганат калия (в быту называют марганцовкой), на трубке - ватка, чтобы в газоотводную трубку не уносился перманганат. Греем. Кислород собираем в стакан методом вытеснения воздуха (это возможно потому, что О2 немного тяжелее воздуха. Наличие О2проверяем тлеющей лучиной. Способ –собирания О2методом вытеснения воды (демонстрация) Кислород можно получить заранее и собрать в газометре (демонстрирую газометр, его устройство и работу). MnO2 4. 2H2O2-------- 2H2O +O2; Реакция идет медленно. При добавлении MnO2 -,бурно. Вопрос: В чем причина? - Добавление оксида марганца (IV) Учитель: При этом оксид Mn(IV) не расходуется. Если взвесить MnO4 до и после реакции, можно убедиться, что его масса не изменилась.
Диоксид Mn – катализатор реакции разложения пероксида водорода. t 5. 2KCEO3------2KCE +3O2 Хлорат К Бертолетова соль (опасна в обращении) Итак, мы будем знать 5 способов получения О2 в лаборатории. Ознакомимся с получением О2 в промышленности. В промышленности О2 получают из воздуха. Сжимая воздух и давая ему быстро расшириться, вызывают его сильное охлаждение. Воздух становиться жидким. При температуре – 196 С кипит и испаряется азот. О2 при этой температуре жидкий. О2 кипит и испаряется при Т – 183 С. Его хранят под давлением 15МПА в стальных баллонах, на баллонах- синяя полоса. А сейчас, ребята, научимся составлять ОС – опорный сигнал. Всё, что мы узнали на уроке, можно подытожить и изобразить очень кратко: 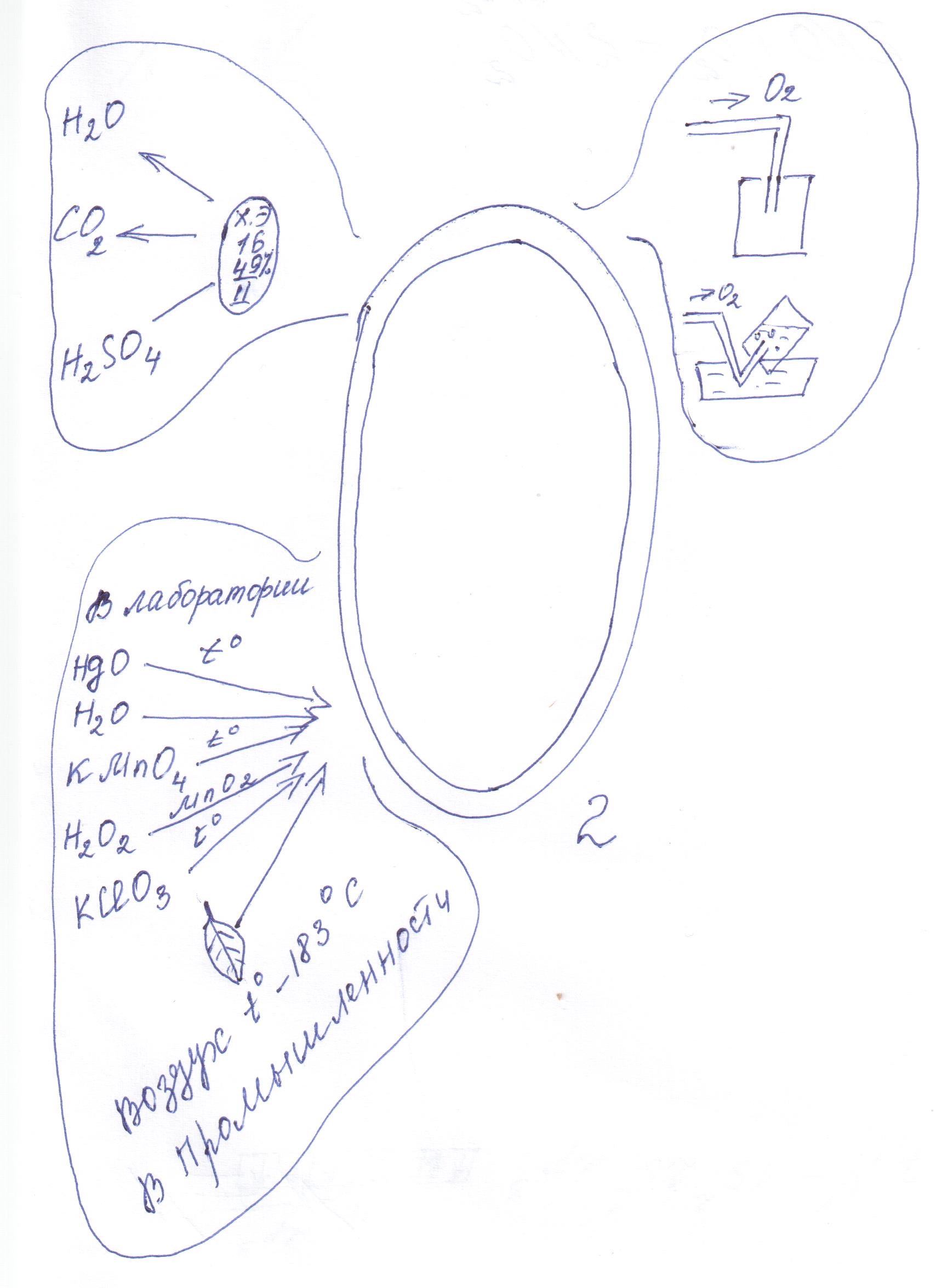 Работа с текстом учебника с. 125. Значение кислорода в природе. Выполнения упр. 5-6 с. 129. Учитель: Круговорот кислорода в природе А сейчас проведем небольшую самостоятельную работу. В-1
А) кислороде – простом веществе; Б) кислороде – химическом элементе; 2. Кислород был открыт: А) М. В. Ломоносовым; Б) Дж. Пристли; В) Р. Бойлем; 3. Катализаторы – это вещества: А) уменьшающие скорость реакции; Б) увеличивающие скорость реакции; В) не изменяющие скорость реакции. 4. В состав оксида фосфора входит кислород- А) химический элемент; Б) простое вещество.. 5. Молекула кислорода состоит из: А) двух атомов; Б) одного атома. В-2
А) горящая лучина потухает; Б) тлеющая лучина загорается. 2. В приведённой записи: 2О2 изображено: А) 2 атома кислорода; Б) 2 молекулы кислорода. 3. Какие вещества образует хим. Элемент кислород в природе: А) простые и сложные вещества; Б) сложные вещества; В) простые вещества. 4. Дж. Пристли получил кислород разложением: А) пероксида водорода; Б) оксида ртути; В) перманганата калия. 5. В воздухе содержится кислород: А) простое вещество; Б) химический элемент. Д/З: 21 упр. 7-8 |