«Коррозия металлов и способы защиты от коррозии»
 Скачать 341.97 Kb. Скачать 341.97 Kb.
|
| Тема: «Коррозия металлов и способы защиты от коррозии» «Жизнь человеческая подобна железу. Если употреблять его в дело, оно истирается, если не употреблять – ржавеет» Катон старший. Древнеримский философ Этой теме предшествовали темы: «Сплавы», «Получение металлов», «Общие химические свойства металлов». Тип урока: изучение и первичное закрепление новых знаний Тип нового знания: введение понятия - коррозия химическая и электрохимическая. Технология: урок комбинированный:
Цель: Сформировать понятие о коррозии металлов, рассмотреть классификацию и причины коррозионных процессов, изучить способы защиты металлов от коррозии. Задачи Образовательные
Развивающее
Воспитательные
Здоровьесберегающие
Оборудование и материалы: ТСО: Компьютеры, ЖК телевизор TOMSON; ЦОР «Влияние кислорода воздуха на коррозию металлов», ЦОР «Влияние ингибитора на скорость коррозии» Оборудование: спиртовка, тигельные щипцы, спички, лотки, пробирки, гвозди, медная проволока, медная и серебряная монеты; Реактивы: Сu, пробирки с заранее подготовленными (за 2 дня) образцами эксперимента по изучению условий коррозии - пробирка №1 - раствор гидроксида натрия +ж.гвоздь пробирка №2 - раствор хлорида натрия +ж.гвоздь. пробирка №3 - раствор хлорида натрия +ж.гвоздь обвитый медной пров. пробирка №4 раствор хлорида натрия +ж.гвоздь +цинк пробирка №5- медная пластина + раствор хлорида натрия; Образцы металлических изделий и сплавов, с разными способами защиты металла от коррозии. Раздаточный материал: опорные конспекты, дидактический материал на столах учащихся для самостоятельной и групповой работы. Компьютерная презентация « Коррозия металлов» Форма организации учебной деятельности: фронтальная, групповая, индивидуальная. Продолжительность урока: 2 академических часа План урока
Ход урока
Приветствие, настрой на работу
Ответы: Правильный ответ: 1 вариант 1-Б, 2-Б, 3-В, 4-В, 5-Б, 2 вариант 1-А, 2–Г, 3–А, 4-А,5-Г ( 1 вариант - ББВВБ 2 вариант - АГААГ) (Написано на доске) Ключ оценивания: 5 «+» – «5» 4 «+» - «4» 3 «+» - «3» 1-2 «+» - «2»
Напишите уравнение получения железа из красного железняка и расставьте коэффициенты с помощью электронного баланса. (Выполняет на развороте доски).
Учитель: Сегодня мы с Вами продолжаем говорить о металлах, их общих свойствах. Тема, которую мы будем рассматривать, волновала человечество издавна, как только оно начало применять металлические изделия. На слайде представлены следующие изображения: доменная печь, Эйфелева башня, ржавое изделие, клинок, яхта, монета, эмалированная посуда, концерт рок-группы. Учащимся предлагается рассмотреть их и ответить на вопрос: «О каком явлении пойдет речь на занятии?». (Слайд № 1) Ученики: Вероятно о явлениях получения и разрушения металлов. Учитель: Как часто вы встречаетесь с явлением разрушения металлов? Ученики: Приводят примеры. (Учитель демонстрирует слайды, с фотографиями изделий, подвергшихся коррозии) (Слайд №2-5) Учитель: А как называется это явление? (ржавление, коррозия) Итак, мы сегодня изучаем процесс коррозии металлов. Зачитываю эпиграф урока и прошу дома поразмышлять над словами философа, что лучше «истираться» – ведя активный образ жизни, или «ржаветь» не работая? Прежде, чем перейти к объяснению и просмотру презентации, предлагаю выполнить задание: на доске записаны вопросительные слова: что?, почему?, как?, какая?, для чего? Составьте, пожалуйста, вопросы к теме «Коррозия металлов и способы защиты от неё» используя данные вопросительные слова. Фронтальный опрос учащихся с фиксированием лучших вопросов на доске. Например: - Что такое коррозия металлов? - Почему возникает коррозия металлов? - Как возникает коррозия металлов? (Как защитить металл от коррозии?) - Какая бывает коррозия? - Для чего надо изучать коррозию? или др. Учитель: Скажите, пожалуйста, какова будет цель нашего урока? Ученики: Получить ответы на поставленные вопросы. Мы должны выяснить:
Учитель: Все явления в природе подчиняются строгим законам. Один из этих законов, в частности, гласит, что из двух состояний с большей вероятностью реализуется то, которое более устойчиво. Так многие соединения, в том числе, оксиды металлов, при нормальных термодинамических условиях устойчивее, чем металлы. Поэтому в земной коре большинство металлов содержатся не в чистом виде, а в форме химического соединения. Особенно часто встречаются соединения металлов с кислородом и серой. Назовите важнейшие руды, используемые для получения железа. Ученики: Красный железняк – Fe2O3, бурый железняк - 2Fe2O3*3H2O, магнитный железняк – Fe3O4. Учитель: Легко ли получить железо из этих руд? Перечислите способы получения металлов. Ученики: Конечно же, нет, железо получают пирометаллургическим способом. Пирометаллургический, гидрометаллургический, электрометаллургический. Учитель: Какой процесс протекает при этом с металлами? (вызывает для объяснений ученика, выполнявшего индивидуальное задание у доски) Ученики: Железо восстанавливается. (Слайд № 8 ) Учитель: Действительно приходится применять сложные и чрезвычайно энергоемкие металлургические процессы, чтобы извлечь металлы из химических соединений, и изготовить из них необходимые предметы. Но большую долю результатов этого труда отнимает у людей злейший враг металлов - коррозия. (слайда № 9) По данным Института физической химии РАН, каждая шестая домна в России работает впустую – весь выплавляемый металл превращается в ржавчину. «Ржа ест железо» - гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, - это яркий пример коррозии. Вы, конечно же, слышали это слово. Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. В повседневной жизни человек чаще всего сталкивается с коррозией железа. (Демонстрация слайдов материалов со следами коррозии) (Слайд № 10-11) Слово коррозия происходит от латинского слова corrodere, что означает разъедать. Так считали древние, а что мы подразумеваем под процессом коррозии? Предполагаемый ответ учеников: Коррозия – это разрушение металлических изделий. Учитель: Коррозия причиняет огромный ущерб, и мы повседневно замечаем следы ее опустошительного действия. Только потери стали из-за коррозии во всем мире оцениваются в сотни миллиардов долларов в год. Помимо этого коррозия причиняет огромный не поддающийся учету ущерб, связанный с выходом из строя коррозирующих деталей, машин, оборудования и сооружений. А загрязнения окружающей среды, вызванные утечкой газа, нефти и других опасных веществ из трубопроводов из-за коррозии, что отрицательно воздействует на здоровье и жизнь людей. В ноябре 2007 года в Керченском заливе во время сильного шторма затонуло 12 судов. Все они были насквозь проржавевшими. Один из них - танкер “Волгонефть-139” разломился пополам. В море вылилось 2000 т мазута. В результате погибло 35000 птиц, несколько десятков километров береговой линии оказались загрязненными. Предварительный ущерб равен 30 млрд. рублям. Самое страшное, что погибли люди. Причиной этого экологического бедствия явился не только шторм, но и человеческий фактор: такие суда нельзя допускать к эксплуатации! (Журнал “Огонек” №49, ноябрь, 2007) Все осознают, что с коррозией надо бороться. А чтобы ее победить нужно, знать причины и механизмы ее протекания. Как вы думаете, почему металлы коррозируют? ( слайд № 12) Ученики: Вероятно, металлы переходят в стабильное состояние, переходя в состав химических соединений, т.е. превращаются в ионы. Учитель: Вы абсолютно правы, с химической точки зрения коррозией называют самопроизвольный процесс разрушения металлов и изделий из них под химическим воздействием окружающей среды, при этом металлы окисляются и переходят в устойчивые формы существования. Учитель: А подвергается ли коррозии алюминий? И каково значение этого процесса? Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Значит, этот процесс коррозии полезен. 4Al + 3O2 → 2 Al2O3 (слайд 14) Учитель: Показывает детям старинные монеты. Что Вы заметили? (слайд № 15-16) Учитель: Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования основных солей меди. 2 Cu + O2+H2O+CO2=CuCO3*Cu(OH)2 Учитель: Возникает ли коррозия без причины? Что может вызвать появление этого процесса? Ученики Окружающая среда. Учитель: Приведите примеры очень агрессивной окружающей среды, которая на ваш взгляд вызывает сильную коррозию. Ученики: Морская вода, кислота, щелочь, растворы солей. Учитель: А воздух влияет на коррозию и почему? Ученики: Конечно, да. Так как в воздухе 21 % -– кислорода. Учитель: Таким образом, получается, что окисление металлов может происходить под действием разных сред, различных окислителей, в разной степени, поэтому ее подразделяют на разные группы (Слайд № 17) Сплошная коррозия распределяется равномерно по всей поверхности металла или сплава (например, процесс ржавления сплавов железа на воздухе или их взаимодействие с сильными кислотами) (слайд № 18). При местной коррозии ее очаги распределяются неравномерно — в виде коррозионных пятен или точек, что особенно опасно для промышленной химической аппаратуры. Учитель: Для выяснения условий возникновения коррозии ваши одноклассники проводили опыты, попросим продемонстрировать и рассказать о результатах поставленных опытов. Рассказ Бучневой Ксении. Чтобы выяснить условия разрушения металлов – коррозии мы провели ряд химических экспериментов. Опыт № 1. (Демонстрирует) Я взяла медную проволоку и внесла ее в пламя спиртовки. Через некоторое время медь чернеет, покрывается оксидом меди (II), т.к. окисляется кислородом, содержащимся в воздухе. Коррозия меди происходит по уравнению: 2 Cu + O2 → 2 CuO (Слайд № 19) Учитель: Продолжит рассказ Старинский Сергей. Он расскажет о наблюдениях, полученных при проведении опытов, поставленных заранее. Старинский Сергей: Для выяснения условий возникновения коррозии мы провели еще один эксперимент, вспомнив, что коррозия протекает очень сильно в воде. Нас, интересовало, что является причиной коррозии: вода или кислород, растворенный в воде? Кислород содержится не только в воздухе, но и в воде, поскольку в ней растворим. Мы провели следующий эксперимент: В две пробирки мы положили железные гвозди. В одну пробирку налили кипяченую воду. Прокипятив ее, мы практически удалили растворенный в ней кислород. Во вторую пробирку налили водопроводной воды. Каждую пробирку закрыли пробками, чтобы перекрыть доступ воздуха, т.е. кислорода. Результаты появились уже на следующий день. Быстрее корродирует гвоздь в некипяченой воде, хотя пробирка и закрыта пробкой, и кислород не поступает в пробирку. Очевидно, коррозия вызывается кислородом, растворенным в воде. (Демонстрируют результаты опытов) Учитель: Вспомните, рассказ учеников об исследованиях и сделайте вывод об условии возникновения коррозии. Ученики: Первое условие возникновения коррозии - это наличие окислителя в окружающей среде. Учитель: Внимательно рассмотрите приведенную ниже модель эксперимента и объясните ее результаты Ученики рассматривают слайд с демонстрацией модели эксперимента (ЦОР «Роль кислорода воздуха в коррозии металлов») Учитель: Почему вода поднялась по трубке? Ученики: Кислород в колбе прореагировал с железом, давление упало и поэтому вода поднимается по трубке. Учитель: Железо под воздействием O2 , H2О постепенно корродирует. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощенным уравнением 4Fe + 3O2 + 6H2О = 4 Fe(OH) 3 Fe0-3е= Fe+3 восстановитель O02+4 е=2O-2 окислитель (Учитель записывает уравнения реакций на доске, а 1 ученик диктует учителю запись электронного баланса уравнения).(Ученики записывают уравнение в своих конспектах). Учитель: В этих опытах мы выяснили роль кислорода воздуха в коррозии железа. Запишем вывод: Кислород является одним из агрессивных факторов коррозии. При этом происходит химическая коррозия. Давайте дадим определение понятию Химическая коррозия. Обратитесь к записям, почему медь, железо коррозируют? Ученики: Окисляются кислородом. Вступают в химическую реакцию Учитель: Какой процесс лежит в основе этого типа коррозии? Ученики: Химическая реакция Учитель: А теперь соедините все вместе, и получится понятие – химическая коррозия Химическая коррозия - это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды. (Слайд № 21) Если на металлы действуют только сухие газы или жидкости, не являющиеся электролитами, то мы имеем дело с химической коррозией (слайд № 22) Учитель: Чаще всего металлы и изделия из них находятся в среде электролита, здесь мы встречаемся со вторым видом коррозии металлов - электрохимической. Что является причиной окисления металлов в случае электрохимической коррозии? Это понятие похоже на предыдущее? Значит, в этой коррозии есть, что-то от химической коррозии, что именно? Что нового добавилось в этом сложном слове? Ученики: Добавилось «Электро» Учитель: С чем у вас ассоциируется слово «Электро» Ученики: Электричество, электрон, электрический ток, электролит. Учитель: Что мы называем электрическим током? Ученики: Электричество или электрический ток – это направленное движение электронов. Учитель: Почему же здесь возникает электрический ток? Нам нужно в этом разобраться. ( слайд № 22-23) Рассмотрим в качестве примера коррозию железа в растворе соляной кислоты в контакте с медью. (демонстрация слайда № 22) При этом возникает гальванический элемент. Более активный металл – железо окисляется и переходит в раствор в виде ионов Fe2+ Fe0 – 2 e →Fe2+ Железо и медь контактируют друг с другом, и электроны, выделяющиеся при окислении железа, перемещаются на медь, где их и получает ион водорода. Т.е возникает движение электронов, а это и есть электрический ток. Ионы же водорода двигаются к меди (катоду), где, принимая электроны, восстанавливаются: 2H+ +2e → H20 Если электролит имеет нейтральную или щелочную среду, тогда на катоде протекает процесс восстановления кислорода, растворенного в электролите: O2+ 2 H2O +4e →4OH- в этом случае образовавшиеся ионы ОН- соединяются с перешедшими в раствор ионами железа Fe2++ 2OH- →Fe(OH)2↓ Fe(OH)2 в присутствии воды и кислорода превращается в Fe(OH)3, который частично отщепляет воду и образующееся вещество отвечает по составу бурой ржавчине yFe2O3* xH2O Учитель: Дадим определение электрохимической коррозии. Ученики: Электрохимическая коррозия – это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды, которое сопровождается возникновением электрического тока. Или это такая коррозия, в результате которой наряду с химическими процессами протекают и электрические. Учитель: ЭХК вызывают главным образом, загрязнения, примеси, содержащиеся в металле, неоднородность химического сотава и структуры, а также неоднородность его поверхности. Согласно теории ЭХК при соприкосновении Ме с электролитом на его поверхности возникают множество микрогальванических элементов. При этом анодом является более активный металл, а катодом –загрязнения, примеси, менее активный металл. Рассказ ученика о Кутубской колонне Объяснение этого факта можно найти в Интернете https://bibliotekar.ru/znak/989-11.htm (Слайд № 23) Учитель: Для закрепления знаний об условиях возникновения коррозии проведем лабораторный опыт и проанализируем его результаты На ваших столах в лотках стоят 5 стаканчиков. В каждый наливали растворы электролитов: в 1- ый 10%- ый раствор NaOH, в остальные 15% - раствор NaCl. В пробирки опускали по железному гвоздю, в 3 –ю гвоздь в контакте с медной проволокой, в 4 –ю гвоздь в контакте с Zn, в 5-ю опустили кусок медной пластины. Эти пробирки опустили одновременно в перевернутом виде в стаканчики. Прошло 2 дня. О том, как происходила коррозия, вы можете судить по объему израсходованного кислорода, т.е. по поднятию уровня жидкости в пробирке и по характеру осадков. Вы должны проследить за изменениями, произошедшими в стаканчиках, зафиксировать результаты наблюдения в таблице опорного конспекта. От каждой группы вывод по результатам анализа читает один ученик, остальные записывают в конспект. Лабораторный опыт Определения влияния условий окружающей среды на скорость коррозии
Учитель: Прошу сделать общий вывод по результатам анализа данных эксперимента. И запишем его в конспект. Общий вывод по работе:
Учитель: А сейчас мы немного отдохнем и приступим к дальнейшей работе Динамическая пауза (10 мин), физкультминутка. Дети слушают музыку. Часть 2 Учитель: Итак, мы выяснили, что такое коррозия, в чем ее сущность, каких видов она бывает, от чего зависит, знаем, что она приносит громадный ущерб человечеству. Осталось познакомиться со способами защиты от коррозии. Защита металлов от коррозии – очень важная задача. Великий Гете сказал: «Просто знать – еще не все, знания нужно уметь использовать». Как защитить металлы от коррозии? Каждая группа будет изучать свой способ защиты в течение 10 мин. используйте для поиска информации разные источники: учебник, приложение № 2, можно воспользоваться ресурсами Интернет. Задание первой группе:
Задание второй группе:
Задание третьей группе:
Задание четвертой группе:
Задание пятой группе:
Задание шестой группе:
По истечению времени каждая группа рассказывает о своем способе защиты металлов. (Учитель показывает постепенно по ходу защиты группой своей темы, слайды №24-28) В ходе рассказа ученики располагают карточки с изученным способом защиты металлов на доске, в зависимости от направления защиты Все способы защиты металлов необходимо записать в конспект Ученики: Записывают в опорный конспект
Учитель: Еще раз посмотрим на слайд с изображениями изделий из металлов. Нужно найти соответствие между каждым изображением и способом защиты. (слайд № 29) Фронтальная работа с классом.
Каждая группа работает совместно над заданиями и выбирает, кто будет отвечать на вопросы заданий. Задания для первой группы
Задания для второй группы
Задания для третьей группы
«Коррозия – рыжая крыса Грызет металлический лом» Что это за рыжая крыса? Всегда ли результат коррозии имеет рыжий цвет?
Задания для четвертой группы
Задания для пятой группы
Задания для шестой группы
Выслушиваем ответы на вопросы каждой группы
Посмотрите на ваши конспекты, заполненные в ходе всего урока. Ответили ли мы на вопросы, которые стояли перед нами в начале урока? Довольны ли вы своей работой на уроке? Как Вы считаете, Ваша группа работала активно или пассивно? Результатов легче добиваться одному или работая коллективом? Прошу сдать листочки анализа работы в группе.
Приложение № 1 Тест для проверки знаний
Приложение № 2 Ингибиторы Науке известно более 5 тысяч ингибиторов коррозии. Например, при длительном хранении стальных изделий их заворачивают в бумагу, пропитанную ингибитором. Известно, что коррозия особенно энергично протекает в кислотной среде. В промышленности нередко обрабатывают различные изделия из металлов кислотами. Например, чтобы удалить с поверхности изделий железную окалину, образующуюся после прокатки железных листов, их с этой целью на некоторое время опускают в особые ванны с кислотой. К сожалению, при таком травлении металлов в раствор переходит и само железо. Нельзя ли сделать так, чтобы кислота удаляла только ржавчину и практически не влияла на металл? Оказывается, можно. В технике давно широко применяют замедлители, или, так называемые, ингибиторы коррозии. Небольшая добавка этих веществ к кислотам (1% от общей массы) приводит к тому, что сами металлы в ней почти не растворяются, но удаляются оксиды металлов, как и под действием обыкновенной кислоты. Такими “ингибированными” кислотами очищают от ржавчины различные металлические изделия, удаляют накипь со стенок паровых котлов. Как правило, “укрощают” кислотную коррозию ингибиторы органического происхождения. Группы учащихся класса выполнили 4 опыта: первая группа учащихся выполняла опыт без ингибитора, вторая – с ингибитором крахмалом, у третьей группы учащихся ингибитором является анилин, а у четвертой – формалин. Инструкция первой группы
Карта – инструкция № 2 Взаимодействие железа с соляной кислотой (ингибитор - крахмал)
Карта – инструкция № 3 Взаимодействие железа с соляной кислотой (ингибитор анилин)
Карта – инструкция № 4 Взаимодействие железа с соляной кислотой (ингибитор формалин)
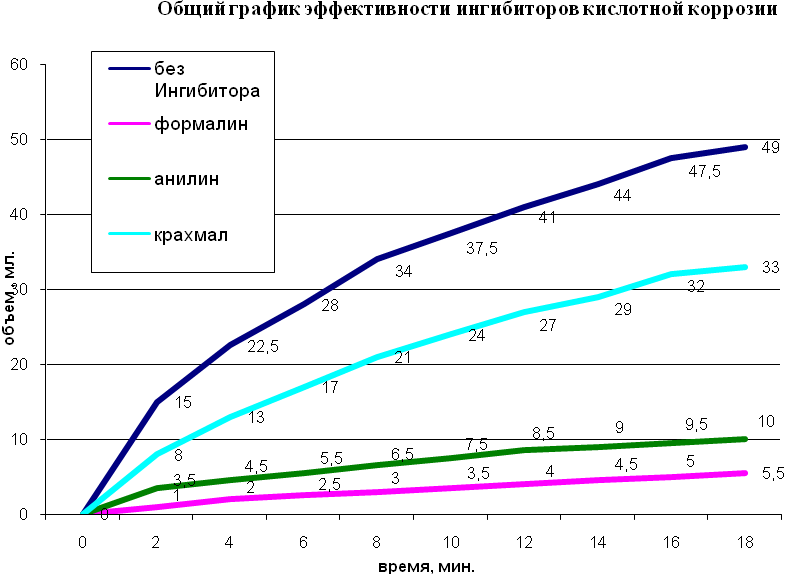 Результаты опытов в таблицах Взаимодействие железа с соляной кислотой без ингибитора Таблица 1
Взаимодействие железа с соляной кислотой (ингибитор – формалин) Таблица 2
А=49мл/5,5мл=9 Взаимодействие железа с соляной кислотой (ингибитор – анилин) Таблица 3
А=49мл/10мл=4,9 Взаимодействие железа с соляной кислотой (ингибитор – крахмал) Таблица 4
А=49мл/33мл=1,5 Задание Внимательно изучите графики и таблицы результатов исследований влияния различных ингибиторов на скорость коррозии железа в кислоте. Какой вывод вы можете сделать. Приложение №3 Способы защиты металлов от коррозии Справочный материал для работы групп. Страницы Интернета https://krasko.ru http://www.neon-san.ru/korozia.htm http://articles.excelion.ru/science/biology/58821304.html Страницы книг и учебников Металлические покрытия делят на две группы: коррозионностойкие и протекторные. Например, для покрытия сплавов на основе железа в первую группу входят никель, серебро, медь, свинец, хром. В электрохимическом ряду напряжений металлов они стоят правее железа. Во вторую группу входят цинк, кадмий, алюминий. По отношению к железу они более активны, т.е. в ряду напряжений находятся левее железа и поэтому сами будут окисляться, а железо останется целым, пока есть еще протектор. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки. И то и другое получают главным образом протягиванием листа железа через расплав соответствующего металла. Для большей стойкости водопроводные трубы и арматуру из стали и серого чугуна часто подвергают оцинковыванию также окунанием в расплав данного металла. Металл, защищенный, таким способом будет, в целостности и сохранности пока поверхность пленки покрывающего металла будет оставаться без повреждений. В местах, где покрытия повреждаются, при наличии влаги происходит электрохимическая коррозия железа. Например: железо, покрытое пассивным металлом никелем. Железо по своей активности превосходит никель, поэтому и окисляется кислородом и переходит в виде ионов в окружающую среду, а на поверхность никеля поступают, электроны атомов железа, которые и восстанавливают окислитель окружающей среды – кислород. Применение ингибиторов – один из эффективных способов борьбы с коррозией металлов в различных агрессивных средах (в атмосферных, в морской воде, в охлаждающих жидкостях и солевых растворах, в окислительных условиях и т.д.). Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от лат. inhibere, что означает сдерживать, останавливать. Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате чего растворялись лишь окалина и ржавчина. Протекторная защита. Металл, который необходимо защитить от коррозии покрывают более активным металлом. Тот металл, который заведомо будет разрушаться в паре, называется протектором. Примеры такой защиты – оцинкованное железо (железо – катод, цинк – анод), контакт магния и железа (магний – протектор). Железо часто покрывают другим металлом, например цинком или хромом, чтобы защитить от коррозии. Оцинкованное железо получают, покрывая его тонким слоем цинка. Цинк защищает железо от коррозии даже после нарушения целостности покрытия. В этом случае железо в процессе коррозии играет роль катода, потому что цинк окисляется легче железа: Защита железных водопроводных труб. М 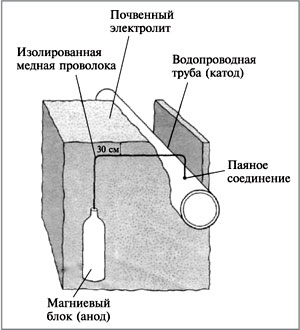 агниевый анод окружают смесью гипса, сульфата натрия и глины, чтобы обеспечить проводимость ионов. Труба играет роль катода в гальваническом элементе (рис. 5. Защита железных водопроводных труб). агниевый анод окружают смесью гипса, сульфата натрия и глины, чтобы обеспечить проводимость ионов. Труба играет роль катода в гальваническом элементе (рис. 5. Защита железных водопроводных труб).Электрозащита. Конструкция, находящаяся в среде электролита, соединяется с другим металлом (обычно куском железа, рельсом и т.п.), но через внешний источник тока. При этом защищаемую конструкцию подключают к катоду, а металл – к аноду источника тока. В этом случае электроны отнимаются от анода источником тока, анод (защищающий металл) разрушается, а на катоде происходит восстановление окислителя. Электрозащита имеет преимущество перед протекторной защитой: радиус действия первой около 2000 м, второй 50 Создание сплавов, устойчивых к коррозии. Если металл, например хром, создает плотную оксидную пленку, его добавляют в железо, и образуется сплав – нержавеющая сталь. Такие стали называются легированными. Большим достижением металлургов в защите от коррозии стало создание коррозионно-стойкой стали. В результате снижения содержания углерода в нержавеющей стали до 0,1 % стало возможным изготовлять из нее листовой прокат. Типичная «нержавейка» содержит 18% хрома и 8% никеля. Первые тонны нержавеющей стали в нашей стране выплавили еще в 1924 г. в Златоусте. Сейчас создан широкий ассортимент сталей, устойчивых к коррозии. Это и сплавы на железохромоникелевой основе, и особо коррозионностойкие никелевые, легированные молибденом и вольфрамом. Эти сплавы производят и на нашем комбинате. Многие сплавы, которые содержат незначительное количество добавок дорогих и редких металлов, приобретают замечательную устойчивость к коррозии и прекрасные механические свойства. Например, добавки родия или иридия к платине так сильно повышают ее твердость, что изделия из нее – лабораторная посуда, детали машин для получения стекловолокна – становятся практически вечными. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||