Лекция : Теория органического строения. Алканы, циклоалканы
 Скачать 120.45 Kb. Скачать 120.45 Kb.
|
| Лекция : Теория органического строения. Алканы, циклоалканы. Основные положения теории химического строения А.М. Бутлерова
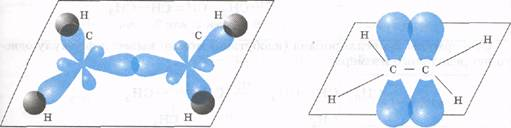
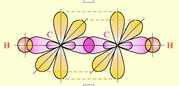
1) Строение атома углерода. Э 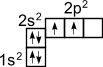 лектронное строение атома углерода изображается следующим образом: 1s22s22p2 или схематически лектронное строение атома углерода изображается следующим образом: 1s22s22p2 или схематическиУглерод в органических соединениях четырехвалентен. Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. Схематически: 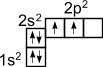 –– –– 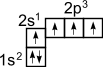 В результате имеется уже не два, а четыре неспаренных электрона. 2) Сигма и пи-связи. П 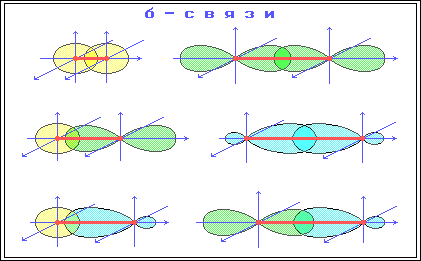 ерекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. ерекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. П 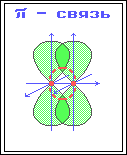 ри дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи и параллельных друг другу, образуются ри дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи и параллельных друг другу, образуются π-связи. В результате этого между атомами возникают кратные связи:
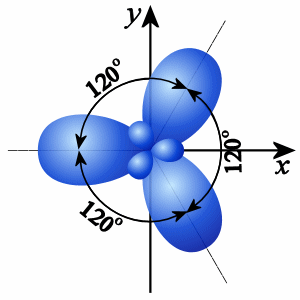
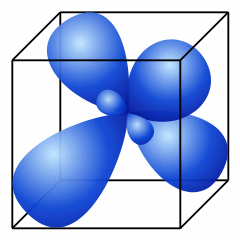
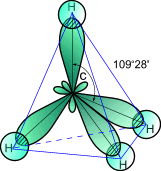
3) Гибридизация. Поскольку четыре электрона у атома углерода различны (2s- и 2p- электроны), то должны бы быть различны и связи, однако известно, что связи в молекуле метана равнозначны. Поэтому для объяснения пространственного строения органических молекул используют метод гибридизации. 1. При обобществлении четырех орбиталей возбужденного атома углерода (одной 2s- и трех 2p- орбиталей) образуются четыре новых равноценных sp3- гибридных орбитали, имеющие форму вытянутой гантели. Вследствие взаимного отталкивания sp3- гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109028' (наиболее выгодное расположение). Такое состояние атома углерода называют первым валентным состоянием. 2. При sp2-гибридизации смешиваются одна s- и две р-орбитали и образуются три гибридные орбитали, оси которых расположены в одной плоскости и направлены относительно друг друга под углом 120°. Такое состояние атома углерода называют вторым валентным состоянием. 3. При sp-гибридизации сливаются одна s- и одна р-орбитали и образуются две гибридные орбитали, оси которых расположены на одной прямой и направлены в разные стороны от ядра рассматриваемого атома углерода под углом 180°. Такое состояние атома углерода называют третьим валентным состоянием. ТИПЫ ГИБРИДИЗАЦИИ в органических веществах.
4) Изомерия. Изомеры – вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. Например, веществ с молекулярной формулой С4Н10 существует два: н-бутан (с линейным скелетом): СН3 – СН2 – СН2 – СН3 и изо-бутан, или 2-метилпропан: СН3 – СН – СН3 │ СН3 Они являются изомерами. Изомерия бывает структурная и пространственная. Структурная изомерия. 1.Изомерия углеродного скелета - обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы (см. бутан и изобутан). 2.Изомерия положения кратной связи или функциональной группы -обусловлена различным положением какой-либо реакционноспособной группы при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: СН3 – СН2 – СН2 – ОН - пропанол-1 или н-пропиловый спирт и СН3 – СН – СН3 │ ОН - пропанол-2 или изопропиловый спирт. Изомерия положения кратной связи, например, в бутене-1 и бутене-2 СН3 – СН2 – СН=СН2 - бутен-1 СН3 – СН=СН – СН3 - бутен-2. 3. Межклассовая изомерия – изомерия веществ, отонсящихся к разным классам органических соединений: - алкены и циклоалканы (с С3) - алкины и диены (с С3) - спирты и простые эфиры (с С2) - альдегиды и кетоны (с С3) - одноосновные предельные карбоновые кислоты и сложные эфиры (с С2) Пространственная изомерия - подразделяется на два вида: геометрическую (или цис-транс-изомерию) и оптическую. Геометрическая изомерия свойственна соединениям, содержащим двойные связи или циклопропановое кольцо; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Понятия «цис» и «транс» обычно относят к паре одинаковых заместителей, а если все заместители разные, то условно к одной из пар. - 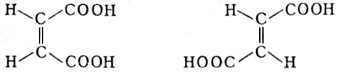 две формы этилен-1,2-дикарбоновой кислоты — цис-форма, или малеиновая кислота (I), и транс-форма, или фумаровая кислота (II) две формы этилен-1,2-дикарбоновой кислоты — цис-форма, или малеиновая кислота (I), и транс-форма, или фумаровая кислота (II) (I) (II) Оптическая изомерия свойственна молекулам органических веществ, не совмещающимся со своим зеркальным отображением (т.е. с молекулой, соответствующей этому зеркальному отображению). Чаще всего оптическая активность обусловлена наличием в молекуле асимметрического атома углерода, т.е. атома углерода, связанного с четырьмя различными заместителями. Примером может служить молочная кислота: CH3-C*HCOOH \ ОН (асимметрический атом углерода отмечен звёздочкой). Молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами). Физические и химические свойства оптических изомеров часто очень похожи, но они могут сильно отличаться по биологической активности, вкусу и запаху. Классификация органических веществ.
Номенклатура органических веществКорни С1 – мет С6 – гекс С2 – эт С7 – гепт С3 – проп С8 – окт С4 – бут С9 – нон С5 – пент С10 – дек Окончания -ан – есть только одинарные связи С−С в молекуле -ен – есть одна двойная связь С=С в молекуле -ин – есть одна тройная связь С≡С в молекуле -диен – есть две двойные связи С=С в молекуле Старшинство функциональных групп в молекуле
|