|
Неметаллы Элементы V группы главной подгруппы

Неметаллы
Общая характеристика - nS2nP3 – строение внешнего энергетического уровня
- На внешнем уровне 5 электронов
- Увеличивается количество энергетических уровней в атоме
- Увеличивается радиус атома
- ослабляется притяжение валентных электронов к ядру
- ослабляются неметаллические и окислительные сойства
- возрастают металлические и восстановительные свойства
- ЭО уменьшается
- Низшая степень окисления в соединениях -3
- Высшая степень окисления в соединениях +5

Азот – простое вещество Молекула азота (:N N:) N2В молекуле имеются одна σ- и две π- связи.Молекула очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью. Открыт Д.Резерфордом в 1772 г. (78% по объему, 75,6% по массе).Газ, без цвета, запаха и вкуса; плохо растворим в воде, не поддерживает дыхание и горение t° кип.= -196°C; t°пл.=-210°C.

Химические свойства азота Молекула азота очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью. В химических реакциях может выступать в роли как восстановителя: N20 2N+2 так и в роли окислителя: N20 2N-3

Восстановительные свойства атомы проявляют при взаимодействии с кислородом при температуре электрической дуги N20 + O2 2N+2O (в природе - во время грозы) Окислительные свойства атомы проявляют при взаимодействии с металлами и водородом: N20 + 3H2 2N-3HЗвзаимодействие с активными металлами (с щелочными и щелочноземельными) при обычных условиях азот взаимодействует только с литием: 6Li0 + N20 2LiЗN-3 3Mg0 + N20 MgЗN2-3 при нагревании В результате взаимодействия образуются нитриды металлов

Получение азота Промышленный способ: Перегонка жидкого воздуха. Лабораторный способ: Разложение нитрита аммония: NH4NO2 N2 + 2H2O Рассмотрите данную реакцию как окислительно - восстановительный процесс

А м м и а к NH3 Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, угол HNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.

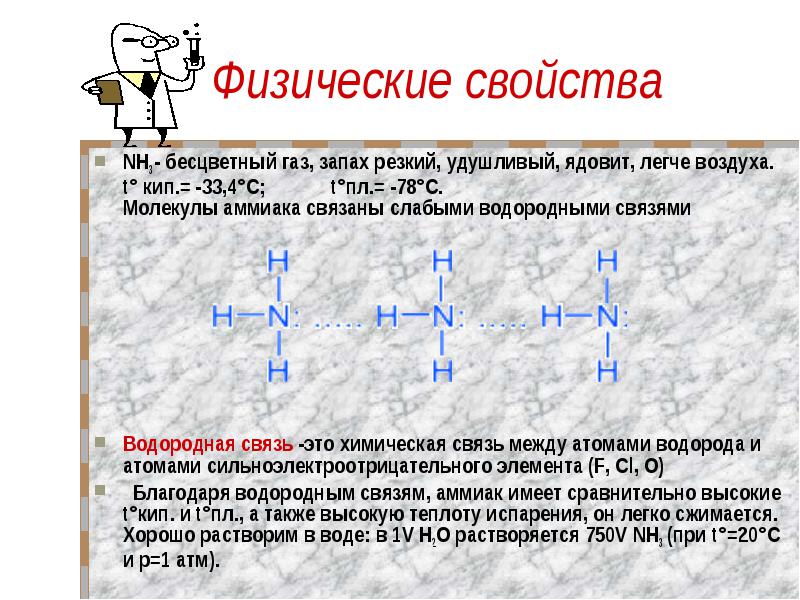
Физические свойства NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха. t° кип.= -33,4°C; t°пл.= -78°C. Молекулы аммиака связаны слабыми водородными связями Водородная связь -это химическая связь между атомами водорода и атомами сильноэлектроотрицательного элемента (F, Cl, O) Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается. Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
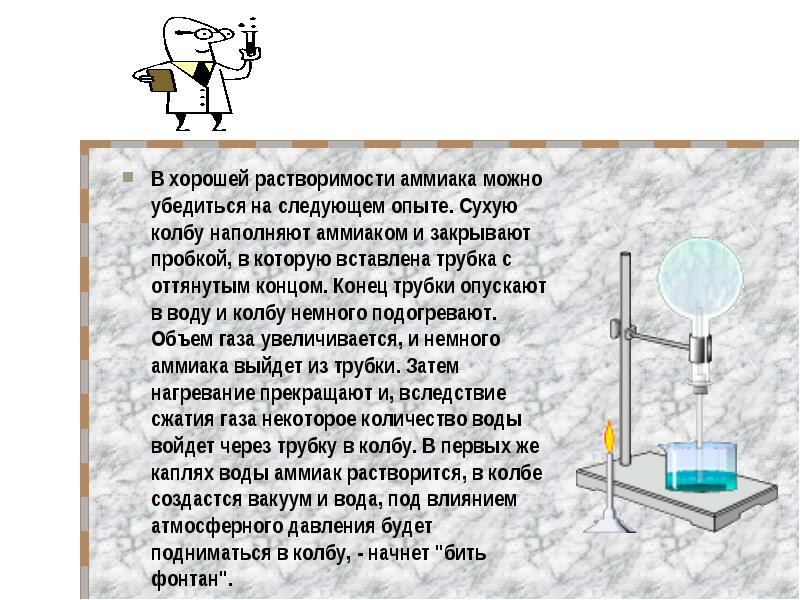
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан". В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".
Получение Промышленный способ: N2 + 3H2 2NH3 (p=1000 атм; t°= 500°C; kat). Лабораторный способ: Нагревание солей аммония со щелочами. 2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 + 2Н2O (NH4)2SO4 + 2KOH K2SO4 + 2NH3 + 2Н2O

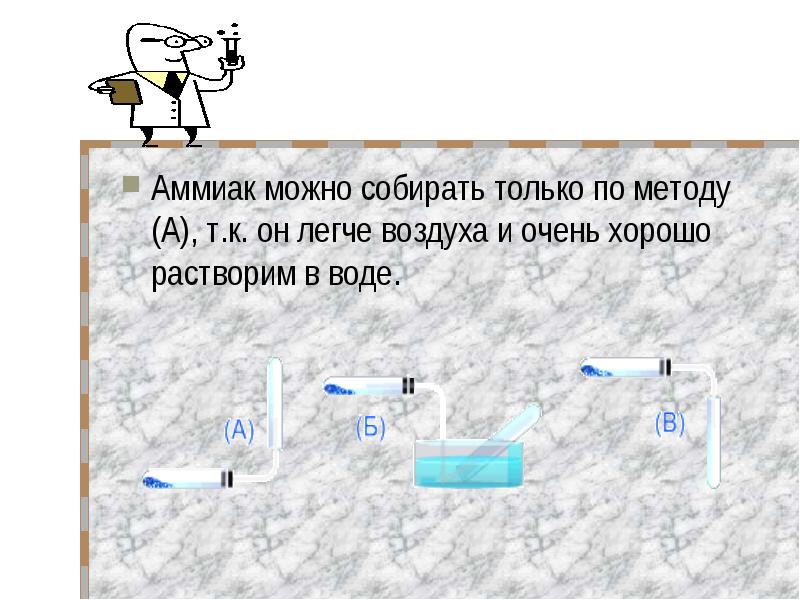
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде. Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства NH3 Образование ковалентной связи по донорно-акцепторному механизму Такой механизм образования связи, который возникает за счет свободной электронной пары, имеющейся у одного из атомов, называется донорно- акцепторным.

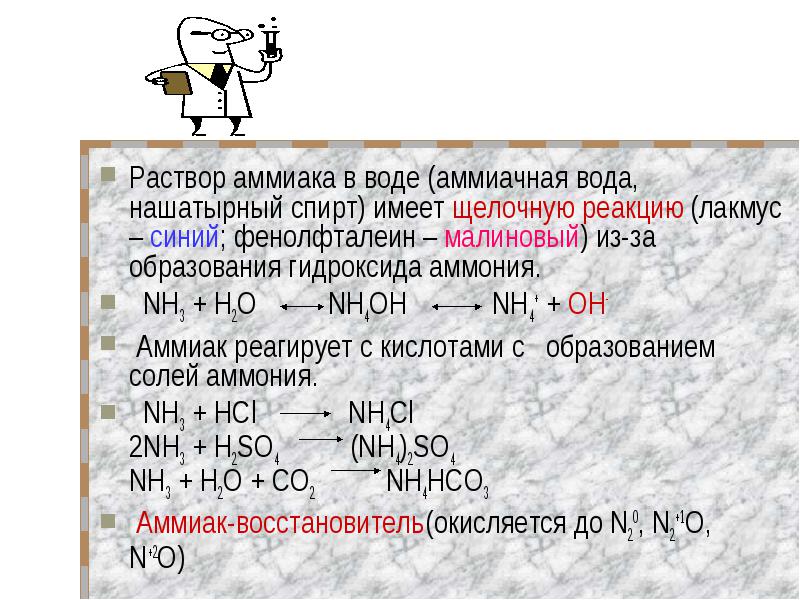
Раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония. Раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония. NH3 + Н2O NH4OH NH4+ + OH- Аммиак реагирует с кислотами с образованием солей аммония. NH3 + HCl NH4Cl 2NH3 + H2SO4 (NH4)2SO4 NH3 + H2O + CO2 NH4HCO3 Аммиак-восстановитель(окисляется до N20, N2+1О, N+2O)
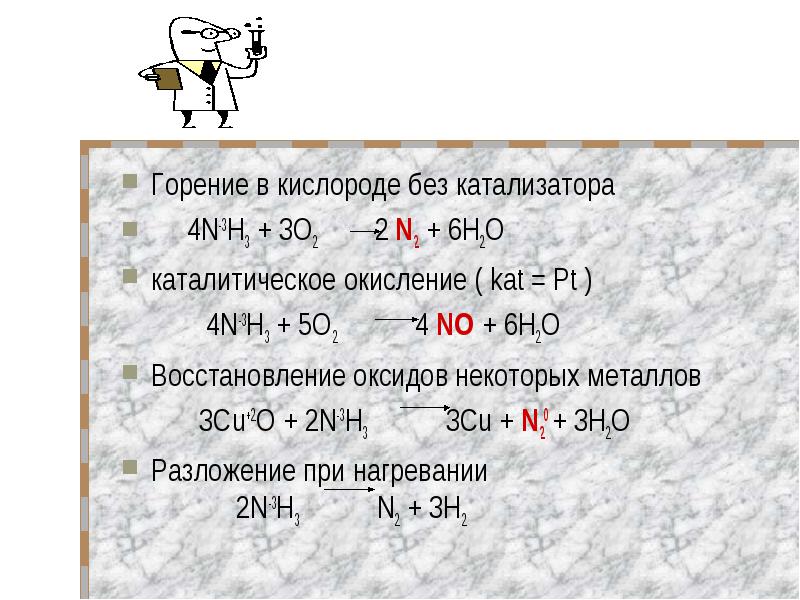
Горение в кислороде без катализатора Горение в кислороде без катализатора 4N-3H3 + 3O2 2 N2 + 6Н2Oкаталитическое окисление ( kat = Pt ) 4N-3H3 + 5O2 4 NO + 6Н2O 3Cu+2O + 2N-3H3 3Cu + N20 + 3Н2OРазложение при нагревании 2N-3H3 N2 + 3H2
Соли аммония Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком. Физические свойства Кристаллические вещества, хорошо растворимые в воде. Получение: Аммиак (или гидроксид аммония) + кислота. NH3 + HNO3 NH4NO3 (нитрат аммония) 2NH4OH + H2SO4 (NH4)2SO4 + 2Н2O (cульфат аммония)

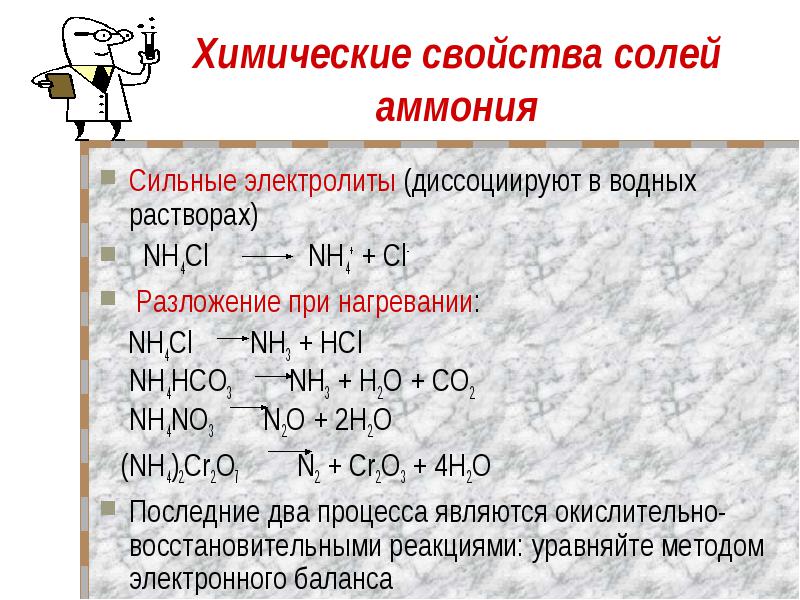
Химические свойства солей аммония Сильные электролиты (диссоциируют в водных растворах) NH4Cl NH4+ + Cl- Разложение при нагревании: NH4Cl NH3 + HCl NH4HCO3 NH3 + Н2O + CO2 NH4NO3 N2O + 2Н2O (NH4)2Cr2O7 N2 + Cr2O3 + 4Н2OПоследние два процесса являются окислительно-восстановительными реакциями: уравняйте методом электронного баланса
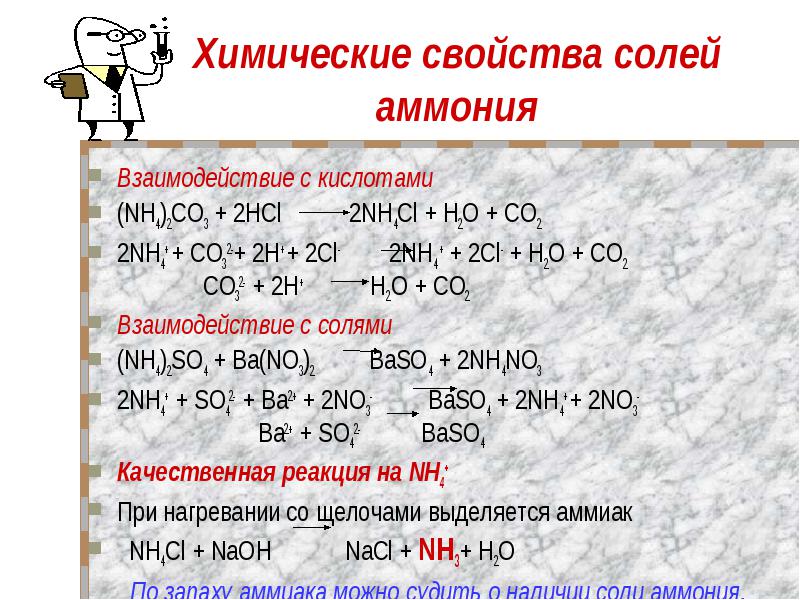
Химические свойства солей аммония Взаимодействие с кислотами (NH4)2CO3 + 2НCl 2NH4Cl + Н2O + CO22NH4+ + CO32-+ 2H+ + 2Cl- 2NH4 + + 2Cl- + Н2O + CO2 CO32- + 2H+ Н2O + CO2Взаимодействие с солями (NH4)2SO4 + Ba(NO3)2 BaSO4 + 2NH4NO32NH4+ + SO42- + Ba2+ + 2NO3- BaSO4 + 2NH4+ + 2NO3- Ba2+ + SO42- BaSO4Качественная реакция на NH4+ При нагревании со щелочами выделяется аммиак NH4Cl + NaOH NaCl + NH3+ Н2O По запаху аммиака можно судить о наличии соли аммония.
Применение солей аммония Хлорид аммония NH4Cl:Гидрокарбонат аммония NH4 HCO3 и карбонат аммония (NH4)2CO3 : применяют в кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным : NH4HCO3 NH3 + H2O + CO2 Нитрат аммония NH4NO3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества – аммонала, который широко применяется при производстве горных работ.

Оксиды азота N2+1O, N+2O, N2+3O3, N+4O2 ,N2+5O5 Оксиды N2O, NO несолеобразующие, а остальные оксиды проявляют свойства типичных кислотных оксидов: N2O3 HNO2 NO2 при растворении в воде дает одновременно две кислоты: 2NO2 + H2O HNO3 + HNO2 4NO2 + 2H2O + O2 4HNO3 Как типичные кислотные оксиды взаимодействуют с водой, с основными оксидами и основаниями – подтвердите это уравнениями соответствующих реакций.

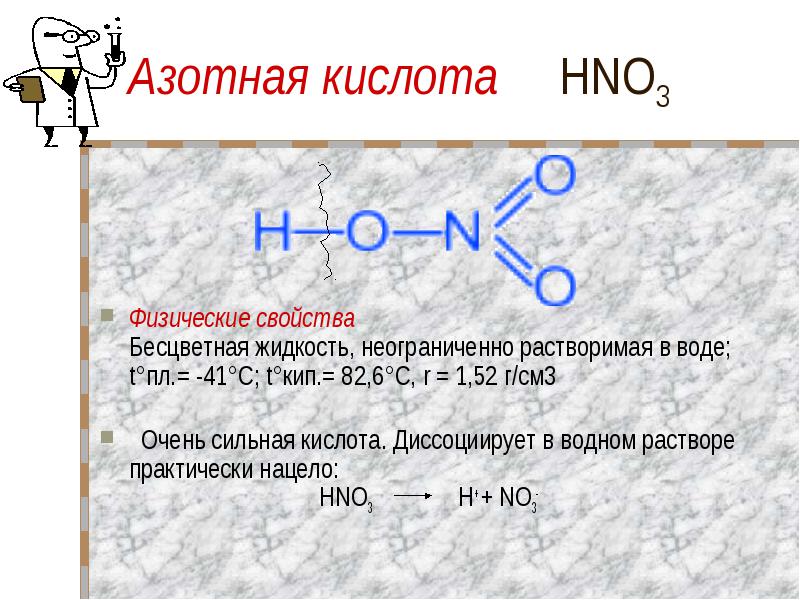
Азотная кислота HNO3 Физические свойства Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3 Очень сильная кислота. Диссоциирует в водном растворе практически нацело: HNO3 H+ + NO3-
Взаимодействует с основными оксидами: CuO + 2HNO3 Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- Cu2+ + 2NO3- + H2O CuO + 2H+ Cu2+ + H2O Взаимодействует с основаниями: HNO3 + NaOH NaNO3 + H2O H+ + NO3- + Na+ + OH- Na+ + NO3- + H2O H+ + OH- H2OВытесняет слабые кислоты из их солей: 2HNO3 + Na2CO3 2NaNO3 + H2O + CO2 2H+ + 2NO3- + 2Na+ + СO32- 2Na+ + 2NO3- + H2O + CO2 2H+ + СO32- H2O + CO2
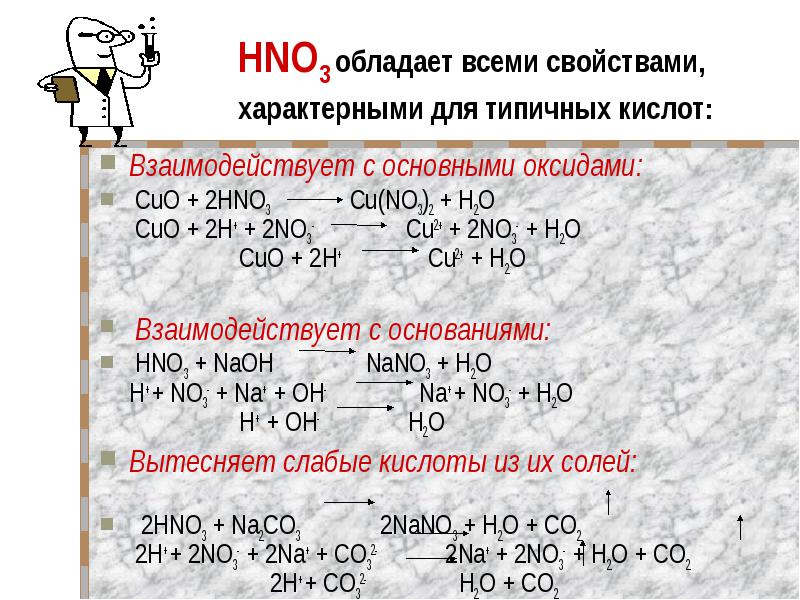
Специфические свойства азотной кислоты HNO3 сильный окислитель Разлагается на свету и при нагревании 4HNO3 2H2O + 4NO2 + O2 Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция") При взаимодействии с металлами никогда не выделяется водород металл + HNO3 соль азотной кислоты + вода + ( NH3, N2, NO, NO2)

Окислительные свойства HNO3 Взаимодействие с металлами:Fe, Al, Cr, Au, Pt HNO3 пассивирует (без нагревания) Окислительные свойства зависят как от концентрации кислоты так и активности металла:HNO3 проявляет окислительные свойства за счет атома N+5Продуктами восстановления азота могут быть: N2O, NO, NO2 , NH3

Окислительные свойства HNO3 Взаимодействие с неметаллами: Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот: S0 + HNO3(конц) H2S+6O4 + NO2 + 2H2O B0 + HNO3 H3B+3O3 + NO2 P0 + HNO3 + H2O NO + H3P+5O4Рассмотрите данные реакции как окислительно- восстановительные процессы, укажите функции веществ в данных реакциях.

Соли азотной кислоты-нитраты 2NaNO3 2NaNO2 + O2 Нитраты менее активных металлов (от щелочноземельных до меди) разлагаются до оксидов:
2Mg(NO3)2 2MgO + 4NO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O2 Нитраты наименее активных металлов разлагаются до металлов: Hg(NO3)2 Hg + 2NO2 + O2 2AgNO3 2Ag + 2NO2 + O2 Нитрат аммония разлагаются до N2O NH4NO3 N2O + 2H2O

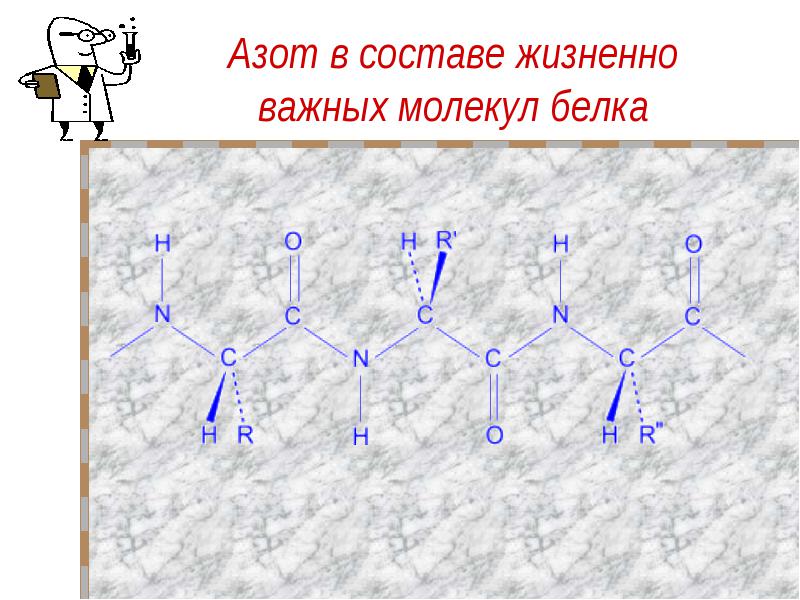
Значение азота Азот- жизненно важный элемент.Все основные части клеток организма построены из белковых молекул, в состав которых входят атомы азота. Без белка нет жизни, а без азота нет белка.Азот входит в состав растительных белков, а животные получают готовые белковые вещества от растений, в животном организме содержится от 1 – 10 % азота по массе.Большое значение имеют особые бактерии, которые живут в клубеньках на корнях бобовых растений (клубеньковые бактерии). Эти бактерии превращают атмосферный азот в соединения, которые могут усваивать растения.

 |
|
|
 Скачать 445 b.
Скачать 445 b.

























