|
Модуль 2.3. Тема: «Валентность. Валентные возможности и
размеры атомов химических элементов»
№ уч.
элемента
|
Учебный материал с указаниями заданий
|
Рекомендации по выполнению заданий, оценка
|
УЭ-0
|
Интегрирующая цель: Изучив материал данного урока, вы получите представления о валентности, ознакомитесь с физическим смыслом этого понятия и причинами различных валентных возможностей атомов, выявите закономерности изменения радиусов атомов химических элементов по периодам и
А – группам периодической системы.
|
Внимательно прочитайте цель урока.
|
УЭ-1
10 мин
|
Входной контроль знаний
Повторите разные способы изображения электронного строения атома.
З   адание. Дано электронное строение атома: адание. Дано электронное строение атома:
n = 1
s
      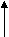 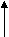 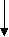 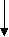  
n = 2
s p
         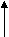 
n 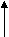  = 3 = 3
s p d
С помощью приведенной схемы электронного строения атома определите:
1) Порядковый номер элемента по периодической системе;
2) заряд ядра его атома;
3) положение в периодической системе (период, группа, подгруппа);
4) составьте электронную формулу элемента;
5) сколько валентных электронов имеет атом этого элемента;
6) каковы высшие валентность и степень окисления этого элемента;
7) какова формула высшего оксида этого элемента, каков его характер; составьте формулу соответствующего гидроксида (основания, кислоты, амфотерного гидроксида)
8)Что означают в это формуле следующие записи:
 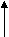     
, , , ,
 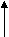 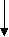 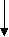 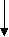
|
Отвечайте на вопросы устно. Работайте в парах.
Оценивается 8 баллами
|
УЭ-2,
УЭ-3
|
1. Получите представление о валентности с позиций теории химической связи.
Задание.
Внимательно прочитайте соответствующий раздел § 5.
Ответьте на вопрос 11, с. 22 учебника.
|
Работайте с учебником, с. 18-19.
Выпишите в тетрадь определение валентности.
Оценивается 1 баллом
|
|
2. Научитесь с помощью графических схем строения внешних электронных слоев атомов определять валентные возможности атомов фтора, фосфора, азота, серы, кислорода; объяснять пятивалентность фосфора и четырехвалентность азота.
Задания:
А. Прочитайте раздел § 5, с. 18 – 20;
Б. Ответьте на вопросы:
Какому из трех чисел периодической системы соответствует численное значение высшей валентности элемента;
Какие исключения есть из предыдущего утверждения;
Сколько валентных (неспаренных) электронов есть в атоме фосфора, который находится в основном состоянии (состоянии с низшей энергией). Чему равна валентность;
Сколько валентных (неспаренных) электронов есть в атоме фосфора, который находится в «возбужденном состоянии». Чему равна валентность;
Справка. Возбужденное состояние - другое стационарное состояние атома, отвечающее определенному состоянию энергии. Оно энергетически нестабильно. Атом переходит из основного в «возбужденное» состояние, получая энергию извне. Возбужденный атом, отдавая энергию, возвращается в основное состояние.
Почему высшая валентность азота не может быть равна пяти? Чему она равна?
Приведите пример соединения азота(IV).
Поясните, почему механизм образования одной из связей атома азота называют донорно – акцепторным;
Объясните, почему сера – элемент с переменной валентностью (II, IV и VI), а кислород и хлор – элементы с постоянной валентностью, которая равна соответственно II и I.
|
Работайте с учебником, § 5, с. 18 - 20
Ответы на вопросы запишите в тетрадь.
Оценивается 7 баллами
|
УЭ-4
|
3. Получите представление о закономерностях изменения радиусов атомов химических элементов и количества электронов на внешнем уровне по периодам и главным подгруппам периодической системы.
Задание. Ответьте на вопрос задания 16, с. 22.
|
Самостоятельно прочитайте § 5, с. 20 – 22.
Ответ на вопрос запишите в тетрадь.
Оценивается 2 баллами
|
|
Подведение итогов урока.
1. Оцените свою работу на уроке.
2. Домашнее задание - записи в тетрадях,
§ 5, письменно ответьте на вопросы заданий № 12-15.
Задачи 3 и 4, с. 23
3. Учитель выборочно берет тетради на
проверку.
4. Выполните дистанционную
самостоятельную работу № 4.
|
Правильные ответы собирает учитель
|
Модуль 3.1. Тема: «Ионная и ковалентная связи.
Ионная, атомная и молекулярная
кристаллические решетки»
№ уч.
элемента
|
Учебный материал с указаниями заданий
|
Рекомендации по выполнению заданий, оценка
|
УЭ-0
|
Интегрирующая цель: В результате систематизации и обобщения знаний по теме вы будете иметь представление о ковалентной и ионной связях, механизмах их образования, о кристаллических решетках, о зависимости свойств вещества от типа его кристаллической решетки
|
Внимательно прочитайте цель урока.
|
УЭ-1
|
Входной контроль знаний
Обобщите сведения об изменении свойств по периодам и главным подгруппам периодической таблицы.
Ответьте на вопросы:
Атом наиболее активного металла имеет электронную конфигурации.
А) 1s22s22p1
Б) 1s22s22p63s1
В) 1s22s2
Г) 1s22s22p63s23p1
2) В ряду химических элементов Na→Mg→Al→Si
А) увеличивается число валентных электронов в атомах
Б) уменьшается число электронных слоев в атомах
В) уменьшается число протонов в ядрах атомов
Г) увеличиваются радиусы атомов
3) По периоду слева направо
А) уменьшается атомный радиус элементов
Б) уменьшается число валентных электронов в атомах
В) Уменьшается электроотрицательность элементов
Г) Ослабевают кислотные свойства гидроксидов
Атом химического элемента, формула высшего
оксида которого R2O7 имеет электронную конфигурацию
А) 1s22s22p63s1
Б) 1s22s1
В) 1s22s22p63s23p64s1
Г) 1s22s22p63s23p5
5) Электронная формула внешнего электронного
слоя атома химического элемента …3s23p4.
Формула высшего гидроксида этого химического элемента
А) R(OH)2
Б) HRO3
В) HRO4
Г) H2RO4
|
Используйте только периодическую систему. Учебник закройте.
Отвечайте на вопросы письменно.
Проверьте себя с помощью кодов.
Оценивается 5 баллами
|
УЭ-2,
УЭ-3
|
1. Систематизируйте знания об ионной, ковалентной (полярной и неполярной) связях, электроотрицательности.
Найдите определения перечисленных выше понятий и перепишите их в тетрадь.
|
Найдите информацию в таблицах Н.Б.Ковалевской (8 класс), с. 72 – 78.
Оценивается 2 баллами
|
|
2. Получите представление о зависимости свойств веществ от вида связи между атомами в этих веществах и типа кристаллической решетки, а также от пространственного расположения частиц относительно друг друга (алмаз, графит).
Заполните таблицу 1.
|
Работайте с учебником, § 6, с. 24 – 26 и
§ 8, таблицами Н.Б.Ковалевской, с. 72 – 78.
Заполните таблицу и сравните ее с образцом. Работайте в парах.
Оценивается 6 баллами
|
УЭ-4
|
Проверьте свои знания по изученной теме.
Задание:
Рассмотрите образцы кристаллических решеток хлорида натрия, алмаза и йода. Укажите, какие частицы находятся в узлах кристаллических решеток. Назовите кристаллические решетки этих веществ и сравните их физические свойства
|
Работайте в группах. Помогайте друг другу.
Оценивается 2 баллами
|
|
Подведение итогов урока.
1. Оцените свою работу на уроке.
2. Домашнее задание - записи в тетрадях,
§ 6, 8, письменно ответьте на вопросы заданий № 1 – 4, 7, с. 41. Задача 1, с. 42.
3. Учитель выборочно берет тетради на проверку.
|
Правильные ответы собирает учитель
|
Таблица 1
Виды химической связи
|
Ионная связь
|
Ковалентная связь
|
Металлическая связь
|
Водородная связь
|
неполярная
|
полярная
|
1. Природа связанных химических элементов
|
|
|
|
|
|
2. Способ образования химической связи
|
|
|
|
|
|
3. Механизм образования химической связи
|
|
|
|
|
|
4. Тип кристаллической решетки
|
|
|
|
|
|
5. Физические свойства вещества
|
|
|
|
|
|
6. Примеры веществ
|
|
|
|
|
|
Модуль 3.2. Тема: «Металлическая и водородная связи.
Металлическая кристаллическая решетка»
№ уч.
элемента
|
Учебный материал с указаниями заданий
|
Рекомендации по выполнению заданий, оценка
|
УЭ-0
|
Интегрирующая цель: : В результате систематизации и обобщения знаний по теме вы будете иметь представление о металлической и водородной связях
|
Внимательно прочитайте цель урока.
|
УЭ-1
|
Входной контроль знаний
Повторите сведения об изученных видах связей и типах кристаллических решеток.
Задание. Ответьте на вопросы:
Вариант 1.
Пользуясь рядом электроотрицательности химических элементов, составьте формулу соединения натрия с азотом. Назовите вид химической связи в этом соединении, обозначьте степень окисления атома каждого химического элемента.
Назовите, какой тип кристаллической решетки характерен для: а) хлорида натрия; б) сульфида натрия; в) сахара; г) «сухого льда» (твердого оксида углерода(IV).
Вариант 2.
Пользуясь рядом электроотрицательности химических элементов, составьте формулу соединения углерода с кремнием. Назовите вид химической связи в этом соединении, обозначьте степень окисления атома каждого химического элемента.
На конкретных примерах сравните физические свойства веществ, имеющих атомные и молекулярные кристаллические решетки.
|
Используйте табл. Н.Б.Ковалевской, с.72.
Ответы запишите в тетради.
Проверьте ответы друг друга (взаимопроверка).
Оценивается 4 баллами
|
УЭ-2,
УЭ-3
|
1. Систематизируйте знания о металлической и водородной связях, металлической кристаллической решетке.
Задание. Продолжите заполнение таблицы 1.
|
Используйте учебник, § 6 и § 8.
Заполните таблицу и сравните ее с образцом. Работайте в парах.
Обратите внимание на два типа водородных связей:
межмолекулярные – между молекулами воды и спирта;
внутримолекулярные – характерны для белков и нуклеиновых кислот.
Оценивается 4 баллами
|
УЭ-4
|
Проверьте полученные на уроке знания
Задание. Дайте письменный ответ на следующий вопрос:
Вариант 1.
Почему при обычных условиях пропан – газ, а этанол – жидкость, хотя их молярные массы близки по значению?
Вариант 2.
Почему металлы обладают высокой электропроводностью?
|
Работайте индивидуально, учебник закрыт.
Для проверки передайте тетрадь соседу по парте.
После проверки исправьте ошибки и дайте им
устное объяснение.
Оценивается 2 баллами
|
|
Подведение итогов урока.
1. Оцените свою работу на уроке.
2. Домашнее задание - записи в тетрадях,
§6, 8, № 8, с. 41.
Задача № 2, с. 42
3. Учитель выборочно берет тетради на проверку.
4. Выполните дистанционную
самостоятельную работу № 5.
|
Правильные ответы собирает учитель
| |
|
|
 Скачать 424.79 Kb.
Скачать 424.79 Kb.
 адание. Дано электронное строение атома:
адание. Дано электронное строение атома: