Урок в 11 классе по теме: «Скорость химических реакций. Факторы, влияющие на скорость химической реакции»
 Скачать 372.52 Kb. Скачать 372.52 Kb.
|
| Модульный урок в 11 классе по теме: «Скорость химических реакций. Факторы, влияющие на скорость химической реакции». Нам необыкновенно повезло, что мы живём в век, когда ещё можно делать открытия! Тип урока: урок изучения нового материала и первичного закрепления знаний. Цели: Обучающие: - продолжить формирование понятия скорость химической реакции; - углубить знания учащихся о факторах, влияющих на скорость химической реакции; Развивающие: - развивать умения делать выводы о зависимости скорости химической реакции от различных факторов; - развивать навыки экспериментальной и практической работы с веществами; - развивать навыки решения расчётных задач. - развивать мотивацию изучения предмета при обращении к жизненному опыту школьников, раскрытии практического значения новых знаний в процессе проведения эксперимента. Воспитательные: - формировать культуру умственного и практического труда, умения проводить рефлексию; - формировать научное мышление учащихся в процессе установления причинно-следственных связей, сравнения и наблюдения объектов и процессов, применения знаний и умений в новых ситуациях; Здоровьесберегающие - мотивировать учащихся на ЗОЖ, соблюдая правила техники безопасности на уроке при проведении эксперимента; - добиваться оптимальной работоспособности в течение всего урока, за счет смены видов деятельности; - создавать благоприятный психологический климат на уроке. Оборудование. Химические реактивы: штатив с пробирками, серная кислота различной концентрации (10% и 5%), кусочки мела и порошок мела, раствор пероксида водорода, оксид марганца (IV), cпиртовка, штатив, цинк гранулированный, магниевая стружка, железная стружка, химическая посуда; раздаточный материал: инструктивные карточки с заданиями, протокол к уроку. Ход урока. Целеполагание, мотивация Учитель: Здравствуйте, ребята. Сегодня мы начнём изучение темы, которая относится к разделу химии, называемой химической кинетикой – это наука о закономерностях протекания химических реакций. Тема урока – скорость химических реакций не является для вас новой. Во первых с понятием скорость вы встречались, изучая другие дисциплины. Во вторых в 8 классе вы получили первичные знания о скорости химических реакций. Знание этой темы имеет очень большое практическое значение. Например, в химической промышленности от скорости химической реакции зависят производительность труда, количество вырабатываемого продукта и, в конечном итоге, зарплата работников и себестоимость продукции. Знание этой темы поможет вам и в быту. Я думаю, что сегодня вы в этом убедитесь. Подпишите, пожалуйста, протоколы к уроку. УЭ – 0 Цели: 1. Актуализировать и углубить знания о скорости химической реакции. 2. Выявить зависимость скорости химических реакций от различных факторов. 3. Раскрыть практическое значение приобретенных знаний о скорости химических реакций. УЭ – 1 Входной контроль Цель: определить исходный уровень знаний необходимых для изучения модуля; Задание 1: Приведите примеры химических реакций, которые протекают: а) практически мгновенно (реакции ионного обмена, взрыв смеси метана с кислородом, сгорание топлива в цилиндре двигателя автомобиля) б) медленно (проследить за их результатами можно лишь по истечении длительного времени) коррозия железа или ферментация (брожение) виноградного сока, в результате которой получается вино, гниение листвы, разрушение зубов) (За каждый правильный ответ -1балл) Слайды о скорости протекания химических реакций в природе Задание 2.Объясните, для чего необходимо замедлять или ускорять реакции: а) скисание молока б) ржавление железа в) горение древесины г) гниение травы (За каждый правильный ответ -1балл) УЭ – 2. Скорость химической реакции. Цель: дать понятие «Скорость химической реакции», учится применять формулы для вычисления средней скорости гомогенных и гетерогенных реакций. Прежде чем говорить о скорости химических реакций, надо вспомнить классификацию химических реакций по фазовому состоянию. Для этого вам предлагается задание. Задания: 1. Вспомните классификацию реакций по фазовому состоянию, для этого составьте уравнения реакций, схемы которых: 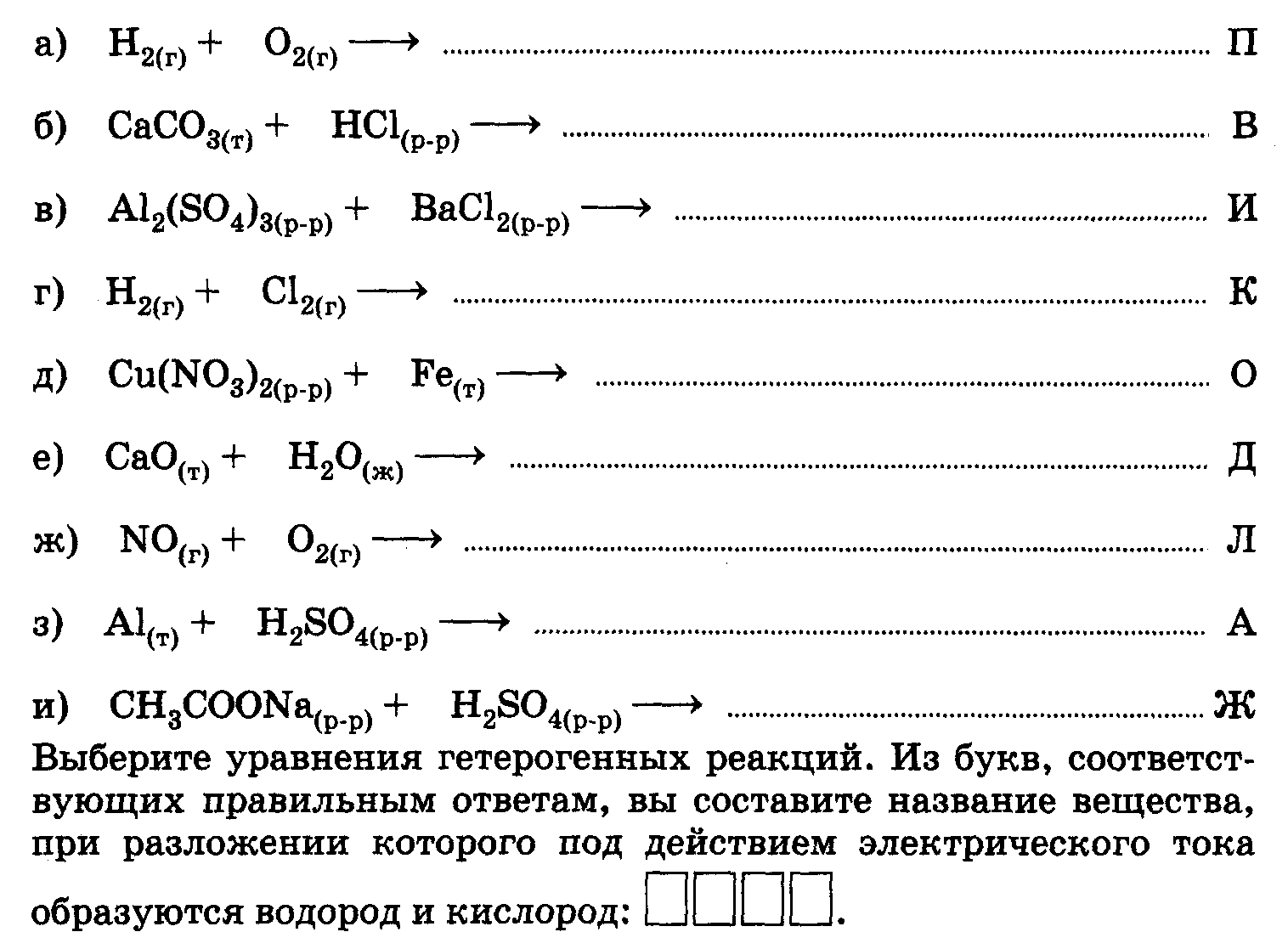  Проверка: а) 2Н2(г) + О2(г) = 2Н2О б) СаСО3(т) + 2HCl(р-р)= СаСl2 + CO2↑+ Н2О в) Al2(SO4)3(р-р) + 3BaCl2(р-р) = 3BaSO4 ↓+ 2AlCl3 г) Н2 + Cl2 = 2HCl д) Сu(NO3)2(р-р) + Fe(т) = Fe(NO3)2 + Сu е) СаО(т) + Н2О(ж) = Са(ОН)2 ж) NO(г) + О2(г) = 2 NO2 з) 2Al(т) + 3H2SO4(р-р) = Al2(SO4)3 + 3Н2↑ и) 2СН3СООNa(р-р) + H2SO4(р-р)= 2СН3СООН + Na2SO4
Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 9). 2. Изучите содержание учебника стр. 128 о скорости химических реакций, ответьте на вопрос: Чем отличается скорость гомогенной реакции от скорости гетерогенной реакции? 3. Решите задачу, используя изученные вами формулы. Задача. Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 мин. Решение
Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2балла, максимальное количество баллов - 4). УЭ – 3. Факторы, влияющие на скорость химической реакции. Цель: выявить зависимость скорости химических реакций от различных факторов. Поучаствуйте в обсуждении: Как вы думаете, от каких факторов зависит скорость химических реакций? Задания: 1. Поиграйте в «крестики-нолики». Факторы, влияющие на скорость химической реакции обозначьте –Х, факторы не влияющие – О. Покажите выигрышный путь, который составляют факторы, влияющие на скорость химической реакции.
Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 9). Учитель: Влияние всех перечисленных факторов на скорость реакции можно объяснить, используя - теорию столкновений частиц. Основная идея её такова: реакции происходят при столкновении частиц, которые обладают определённой энергией. Для того чтобы какие-то частицы прореагировали, они, прежде всего, должны столкнуться. Причем столкнуться эффективно: не разлететься как мячики в разные стороны, а так, чтобы в частицах разрушились или ослабли «старые связи» и смогли образоваться «новые», а для этого частицы должны обладать достаточной энергией. Таким образом, на пути всех частиц, вступающих в реакцию, имеется энергетический барьер, равный энергии активации Еа, если он маленький, то находится много частиц, которые успешно его преодолевают. При большом энергетическом барьере, необходима дополнительная энергия для его преодоления (проследить аналогию с обычным спортивным барьером разной высоты и учащимися класса, его преодолевающими). Еа – минимальный избыток энергии, который должна иметь частица, чтобы произошло эффективное соударение. Еа – характеристика, которая отвечает на вопрос: «Почему изменяется скорость реакции?» 2. Изучите приложение 1 3. Просмотрите видеоролики, ответьте на вопрос: от каких факторов зависит скорость химической реакции в каждом видеофрагменте? Объясните эту зависимость с т. з. теории столкновений и изменения Еа. 4. Решите предложенные задачи. Видео 1. Зависимость скорости химической реакции от природы реагирующих веществ Задача 1 (с экологическим содержанием): Известно, что для полного гниения брошенной в лесу газеты потребуется год, для ржавления консервной банки – десять лет, а стекло практически не разрушается и в течение столетий. Что можно сказать о скорости названных химических процессов? Какой практический вывод можно сделать из приведенных примеров? Ответ: Скорость реакции гниения газеты больше скорости разложения консервной банки, что в свою очередь больше скорости разрушения стекла. Чтобы утилизировать старые консервные банки и стекло, необходимо проводить их предварительную обработку и только потом отправлять на свалку. А также ни в коем случае не оставлять где-либо просто брошенные банки или битое стекло (например в лесу, в походе). Видео 2. Зависимость скорости химической реакции от температуры Экспериментально установлено, что при увеличении температуры на каждые 10 ºС скорость реакции увеличивается в 2-4 раза (на 100-300%). Последнее заключение на основе проведенных исследований сделал в прошлом веке голландский физико-химик Я. Вант-Гофф (первый нобелевский лауреат по химии). Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10 ºС, называют температурным коэффициентом. Правило Вант-Гоффа математически выражается следующей формулой: V1 = V2 · γ (t2-t1)/10 , где V1 - скорость реакции при температуре t1 и v2 – скорость реакции при температуре t2, j – температурный коэффициент. Правило Вант-Гоффа справедливо лишь при температурах, не сильно отличающихся от комнатной. Для осуществления химических процессов в промышленности подбирают оптимальную температуру, так как повышение температуры без ограничений может привести к разложению веществ, к протеканию побочных реакций, в итоге – к снижению выхода продукта. Решите задачу, используя приложение1 Задача 2. Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10 до 500С; б) при понижении температуры от 100 – 00 С. Температурный коэффициент реакции равен 3. а) подставить данные задачи в формулу (слайд 13): скорость реакции увеличится в 81 раз. б) Скорость реакции уменьшится в 3 раза. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2балла, максимальное количество баллов - 4). Объясните, почему скоропортящиеся продукты хранят в холодильнике. Видео 3 Зависимость скорости химической реакции от концентрации реагирующих веществ На основе большего экспериментального материала в 1867 г. норвежские ученые К. Гульдберг и П. Ваге и независимо от них в 1865 г. русский ученый Н. И. Бекетов сформулировали основной закон химической кинетики, устанавливающий зависимость скорости реакции от концентрации реагирующих веществ: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции. (Закон действующих масс) По закону действующих масс скорость реакций, уравнение которой А + В = С, может быть вычислена по формуле: V = k1CACB , а скорость реакции, уравнение которой А + 2В = D, может быть вычислена по другой формуле: V = k2CACB2 В этих формулах СА и СВ – концентрации веществ А и В (моль/л), k1 и k2 – коэффициенты пропорциональности, называемые константами скоростей реакций. Эти формулы называют также кинетическими уравнениями. Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, так как они реагируют на поверхности и их концентрации обычно являются постоянными, они не учитываются при нахождении скорости реакции. Используя приложение 1, решите задачу: Задача 3: Для реакции: 2СО + О2 = 2СО2 запишите выражение закона действующих масс (кинетическое уравнение). Рассчитайте скорость этой реакции при концентрациях СО = 0,04 моль/л, О2 = 0,1 моль/л, если константа скорости реакции равна 1,2 л/моль · с  Решение: Решение:Дано: С (СО)= 0,04 моль/л V = k · C2СО · C О2, С (О2) = 0,1 моль/л V =1,2 л/моль · с · 0,042 моль/л · 0,1 моль/л = 0,000192 моль/л · с k = 1,2 л/моль · с  Ответ: V = 0,000192 моль/л · с Ответ: V = 0,000192 моль/л · сVхим.р - ? Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 2). Учитель:В случае гетерогенных реакций концентрации твёрдых веществ не учитываются. Видео 4: Зависимость скорости химической реакции от действия катализаторов Неосуществимых реакций нет, а если реакция не идёт, то пока ещё не найден катализатор. Н. Н. Зелинский Сообщение учащегося о применении катализаторов Катализаторы имеют следующие области применения: - в нефтяной промышленности для крекинга углеводородов (с его помощью увеличивается выход бензина и керосина) и риформинга (который приводит к перестройке структуры углеводородов и повышению октанового числа бензина) - при переработке природного газа - при производстве серной и азотной кислот, аммиака, синтетического метилового и этилового спиртов, других продуктов органического и неорганического синтеза - при получении полимеров и искусственного каучука - для защиты воздуха от газообразных загрязнений в очистных сооружениях на химических предприятиях и в выхлопных трубах автомобилей (каталитические преобразователи). В этом случае выхлопные газы, содержащие углеводороды и угарный газ, пропускают через слой шариков, покрытых платиновыми и палладиевыми катализаторами. Преобразователь нагревают и через него прогоняют избыток воздуха. В результате углеводороды и угарный газ превращаются в углекислый газ и воду, которые являются безвредными веществами. Каталитические преобразователи используют также для восстановления оксидов азота в свободный азот. Кроме катализаторов, есть вещества противоположного действия – ингибиторы. Они реагируют с активными частицами с образованием малоактивных соединений, а потому замедляют протекание реакций. И такие реакции нужны, чтобы предотвращать нежелательные последствия. Например, с помощью ингибиторов стабилизируют раствор перекиси водорода, соляную кислоту, чтобы была возможна её транспортировка в стальной таре, борются с коррозией металлов. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением. Учитель: Очень эффективно работают биологические катализаторы – ферменты. Как вы помните, по химической природе - это белки. Благодаря им, в живых организмах при невысокой температуре с большой скоростью протекает множество сложных химических реакций. Ферменты используют в таких технологических процессах, как приготовление пищи, производство пищевых продуктов и напитков, фармацевтических препаратов, моющих средств, текстильных изделий, кожи, бумаги. Ферменты отличаются особой специфичностью, каждый из них ускоряет только «свою» реакцию, идущую в нужное время и в нужном месте с выходом, близким к 100%. Создание аналогичных ферментам искусственных катализаторов – мечта химиков! Зависимость скорости химической реакции от поверхности соприкосновения реагирующих веществ (рассмотрим в ходе л. р.) УЭ – 4 Лабораторная работа (лабораторная работа проверяется учителем) Цель: экспериментально доказать зависимость скорости химических реакций от различных факторов. Задание: Осуществите предложенные реакции, заполните таблицу, сделайте выводы о зависимости скорости химической реакции от различных факторов; Внимание! При проведении эксперимента соблюдайте правила техники безопасности!
Лабораторная работа: « Изучение условий, влияющих на скорость химических реакций».
УЭ – 5. Выходной контроль. Графический диктант Цель: проверить уровень усвоения знаний. Задание: Выполните графический диктант, заполните таблицу (отметьте шалашиком “^” на отрезке номер положения, которое считается верным и прочерком “-” неверный ответ). 1. Скорость гомогенной химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени? 2. Скорость гетерогенной химической реакции измеряется: моль/л·с? 3. Зависимость скорости реакции от температуры установил русский учёный Н. И. Бекетов. 4. Гетерогенными называют реакции, которые идут между веществами в неоднородной среде? 5. При повышении температуры на каждые 10° С скорость реакции увеличивается в 2-4 раза? 6. Большинство реакций в организме человека происходит под действием ферментов. 7. Использование катализатора увеличивает энергию активации реакции; 8. Ингибиторы – вещества, замедляющие скорость химических реакций.
Обменяйтесь протоколами, проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 8). Закончите предложения: Знания о влиянии на скорость химической реакции внешних факторов мне необходимы для того … Фронтально опросить 5 – 6 учащихся. Оцените себя (за каждый правильный ответ -1балл) Общий вывод: знание вопроса о скорости химической реакции имеет большое теоретическое и практическое значение: позволяет управлять химической реакцией и правильно планировать химические производства. УЭ – 6. Рефлексия. Домашнее задание. Цель: подвести итоги урока, выставить оценки, определить себе домашнее задание. Прочтите ещё раз цели урока. Оцените, насколько вы смогли их достичь? Подсчитайте общее количество баллов и поставьте себе оценку за урок. Если вы набрали 40 - 36 баллов, то ваша оценка «5». Молодец! Если вы набрали 35 - 31 балл, то ваша оценка «4». Хорошо! Если вы набрали 30 - 25 баллов, то ваша оценка «3». Устраните пробелы в знаниях. Менее 25 баллов, то ваша оценка «2». К сожалению, вы не усвоили материал этого раздела. Приложите все усилия для ликвидации пробелов в знаниях. Пройдите модуль ещё раз. Домашнее задание:
Урок окончен. Спасибо за совместную работу! Инструктивная карта Тема: «Скорость химических реакций. Факторы, влияющие на скорость химической реакции». УЭ – 0 Цели: 1. Актуализировать и углубить знания о скорости химической реакции. 2. Выявить зависимость скорости химических реакций от различных факторов. 3. Раскрыть практическое значение приобретенных знаний о скорости химических реакций. УЭ – 1 Входной контроль Цель: определить исходный уровень знаний необходимых для изучения модуля; Задание 1: Приведите примеры химических реакций, которые протекают: а) практически мгновенно б) медленно (За каждый правильный ответ -1балл) Задание2: Объясните, для чего необходимо замедлять или ускорять реакции: а) скисание молока б) ржавление железа в) горение древесины г) гниение травы (За каждый правильный ответ -1балл) УЭ – 2. Скорость химической реакции. Цель: дать понятие «Скорость химической реакции», учиться применять формулы для вычисления средней скорости гомогенных и гетерогенных реакций. Задания: 1. Вспомните классификацию реакций по фазовому состоянию, для этого составьте уравнения реакций, схемы которых даны в протоколе к уроку. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 9). 2. Изучите содержание учебника стр. 128 о скорости химических реакций, ответьте на вопрос: Чем отличается скорость гомогенной реакции от скорости гетерогенной реакции? 3. Решите задачу, используя изученные формулы (учебник стр. 128): Химическая реакция протекает в растворе, согласно уравнению: А+В = С. Исходные концентрации: вещества А – 0,80 моль/л, вещества В – 1,00 моль/л. Через 20 минут концентрация вещества А снизилась до 0, 74 моль/л. Определите: а) среднюю скорость реакции за этот промежуток времени; б) концентрацию вещества В через 20 мин. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2балла, максимальное количество баллов - 4). УЭ – 3. Факторы, влияющие на скорость химической реакции. Цель: выявить зависимость скорости химических реакций от различных факторов. Поучаствуйте в обсуждении: Как вы думаете, от каких факторов зависит скорость химических реакций? Задания: 1. Поиграйте в «крестики-нолики». Факторы, влияющие на скорость химической реакции, обозначьте – Х, факторы не влияющие – О. Покажите выигрышный путь, который составляют факторы, влияющие на скорость химической реакции (таблица в протоколе к уроку). Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 9). 2. Послушайте объяснение учителя о теории столкновения частиц. 3. Изучите приложение 1. 4. Просмотрите видеоролики, ответьте на вопрос: от каких факторов зависит скорость химической реакции в каждом видеофрагменте? Объясните эту зависимость с т. з. теории столкновений и изменения Еа. 5. Решите предложенные задачи, используя приложение 1 Задача1. Известно, что для полного гниения брошенной в лесу газеты потребуется год, для ржавления консервной банки – десять лет, а стекло практически не разрушается и в течение столетий. Что можно сказать о скорости названных химических процессов? Какой практический вывод можно сделать из приведенных примеров? Устное обсуждение задачи (За каждый правильный ответ -1балл) Задача2. Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10 до 500С; б) при понижении температуры от 100 – 00 С. Температурный коэффициент реакции равен 3. Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -2балла, максимальное количество баллов - 4). ! Объясните, почему скоропортящиеся продукты хранят в холодильнике? Задача 3. Для реакции: 2СО + О2 = 2СО2 запишите выражение закона действующих масс (кинетическое уравнение). Рассчитайте скорость этой реакции при концентрациях СО = 0,04 моль/л, О2 = 0,1 моль/л, если константа скорости реакции равна 1,2 л/моль · с Проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 2). 6. Прослушайте сообщение о применении катализаторов и ингибиторов. УЭ – 4 Лабораторная работа (проверяется учителем) Цель: экспериментально доказать зависимость скорости химических реакций от различных факторов. Работа в парах! Задание: Осуществите предложенные реакции (таблица в протоколе к уроку), сделайте выводы о зависимости скорости химической реакции от различных факторов; расскажите одноклассникам о ваших наблюдениях. Внимание! При проведении эксперимента соблюдайте правила техники безопасности!
УЭ – 5. Выходной контроль. Графический диктант Цель: проверить уровень усвоения знаний. Задание 1: Выполните графический диктант, заполните таблицу в протоколе (отметьте шалашиком “^” на отрезке номер положения, которое считается верным и прочерком “-” неверный ответ). 1. Скорость гомогенной химической реакции определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени? 2. Скорость гетерогенной химической реакции измеряется: моль/л·с? 3. Зависимость скорости реакции от температуры установил русский учёный Н. И. Бекетов. 4. Гетерогенными называют реакции, которые идут между веществами в неоднородной среде? 5. При повышении температуры на каждые 10° С скорость реакции увеличивается в 2-4 раза? 6. Большинство реакций в организме человека происходит под действием ферментов. 7. Использование катализатора увеличивает энергию активации реакции; 8. Ингибиторы – вещества, замедляющие скорость химических реакций. Обменяйтесь протоколами, проверьте правильность выполнения задания и оцените себя (за каждый правильный ответ -1балл, максимальное количество баллов - 8). Задание 2. Закончите предложение в протоколе к уроку: Знания о влиянии на скорость химической реакции внешних факторов мне необходимы для того … Оцените себя (за каждый правильный ответ -1балл) УЭ – 6. Рефлексия. Домашнее задание. Цель: подвести итоги урока, выставить оценки, определить себе домашнее задание.
Спасибо за совместную работу! Протокол модульного урока учащегося 11 класса Фамилия, имя __________________________________ УЭ – 1 Входной контроль Устные ответы Количество баллов__________ УЭ – 2. Скорость химической реакции. Задание 1: 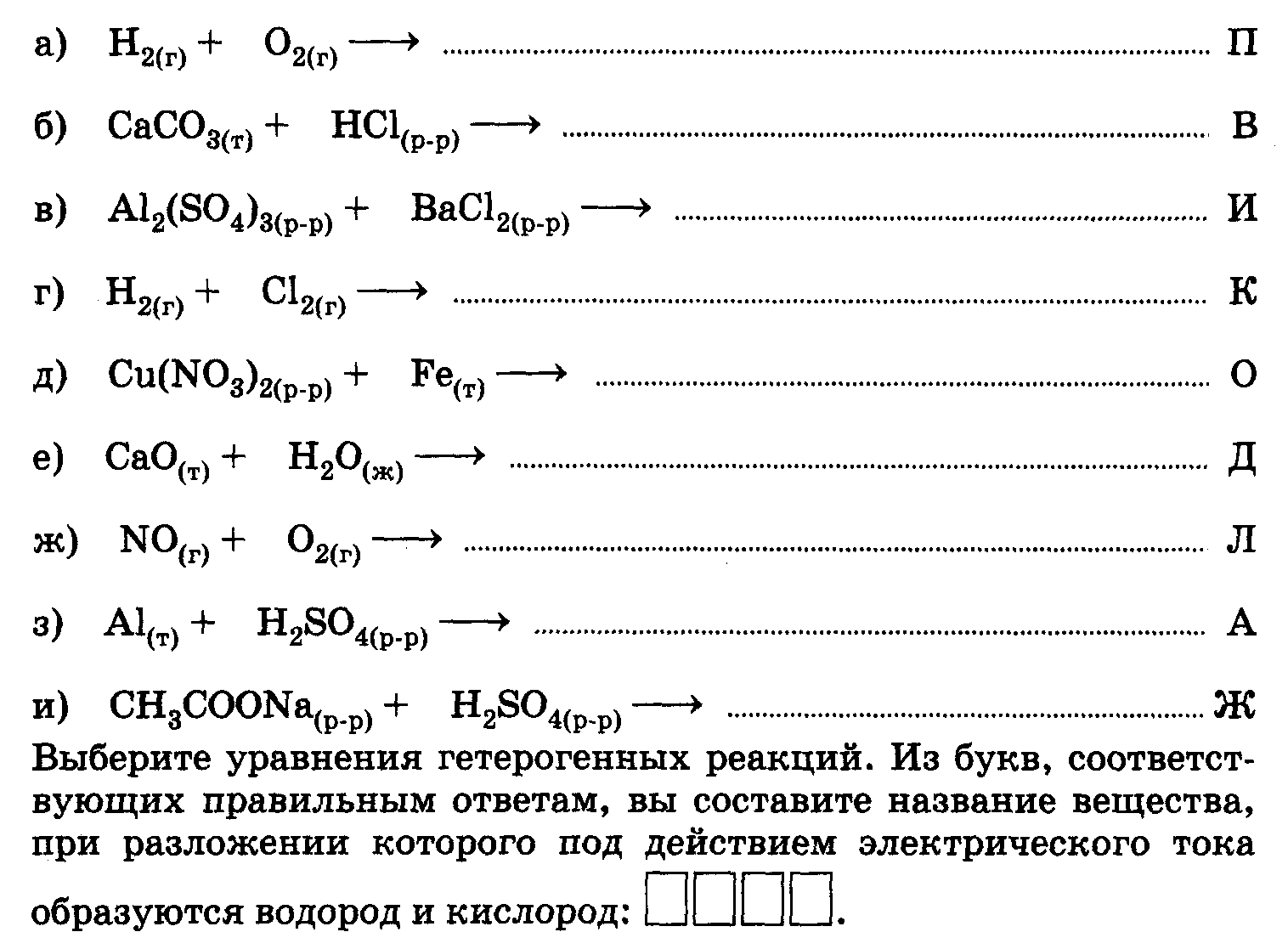 Количество баллов__________ Задание 3:
Количество баллов__________ УЭ – 3. Факторы, влияющие на скорость химической реакции. Задание 1 «Крестики-нолики»
Количество баллов__________ Задание 3. Решите предложенные задачи Задача 1. Обсуждение задачи – устные ответы Количество баллов__________ Задача 2. Решение: ______________________________________________________________________________________________________________________________________________________________________________________ Количество баллов__________ Задача 3. Дано: Р  ешение: ешение:С (СО)= 0,04 моль/л С (О2) = 0,1 моль/л k = 1,2 л/моль · с  Vхим.р - ? Количество баллов__________ УЭ 4. Лабораторная работа: « Изучение условий, влияющих на скорость химических реакций».
УЭ – 5. Графический диктант: Задание 1.
Количество баллов__________ Задание 2. Знания о факторах, влияющих на скорость химической реакции мне необходимы для того … _______________________________________________________________________________________________ _______________________________________________________________________________________________ Количество баллов__________ УЭ – 6. Рефлексия. Домашнее задание. Общее количество баллов:________________ Оценка:____________ Спасибо за совместную работу!
 Закономерности изменения скорости химической реакции в зависимости от различных факторов Приложение 1
Приложение 1 Закономерности изменения скорости химической реакции в зависимости от различных факторов
Сообщение о применении катализаторов и ингибиторов. Катализаторы имеют следующие области применения: - в нефтяной промышленности для крекинга углеводородов (с его помощью увеличивается выход бензина и керосина) и риформинга (который приводит к перестройке структуры углеводородов и повышению октанового числа бензина) - при переработке природного газа - при производстве серной и азотной кислот, аммиака, синтетического метилового и этилового спиртов, других продуктов органического и неорганического синтеза - при получении полимеров и искусственного каучука - для защиты воздуха от газообразных загрязнений в очистных сооружениях на химических предприятиях и в выхлопных трубах автомобилей (каталитические преобразователи). В этом случае выхлопные газы, содержащие углеводороды и угарный газ, пропускают через слой шариков, покрытых платиновыми и палладиевыми катализаторами. Преобразователь нагревают и через него прогоняют избыток воздуха. В результате углеводороды и угарный газ превращаются в углекислый газ и воду, которые являются безвредными веществами. Каталитические преобразователи используют также для восстановления оксидов азота в свободный азот. Кроме катализаторов, есть вещества противоположного действия – ингибиторы. Они реагируют с активными частицами с образованием малоактивных соединений, а потому замедляют протекание реакций. И такие реакции нужны, чтобы предотвращать нежелательные последствия. Например, с помощью ингибиторов стабилизируют раствор перекиси водорода, соляную кислоту, чтобы была возможна её транспортировка в стальной таре. Ингибиторы содержатся и в живых организмах, они подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением. |