|
Урок химии в 9 классе по тме: „Азот Цель урока: сформировать понятие об азоте как о химическом элементе и простом веществе

Урок химии в 9 классе по тме: „Азот“ Цель урока: сформировать понятие об азоте как о химическом элементе и простом веществе.
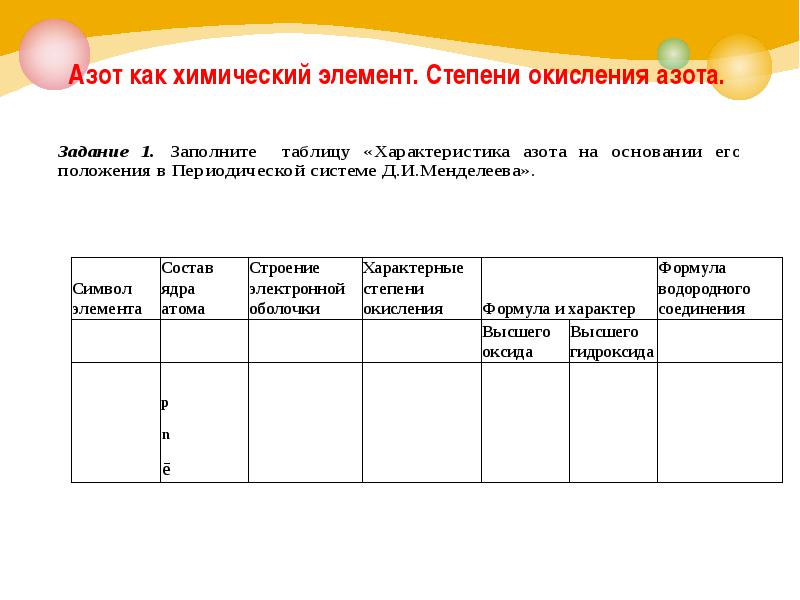
Характеристика азота на основании его положения в Периодической системе Д.И.Менделеева АЗОТ (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067.

Азот как химический элемент. Степени окисления азота.
Азот как простое вещество АЗОТ в свободном виде — газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Получение азота В лаборатории чистый («химический») азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:NaNO2 + NH4Cl = NaCl + N2 + 2H2O.Можно также нагревать твердый нитрит аммония:NH4NO2 = N2 + 2H2O.

Задание 2. Заполните схему
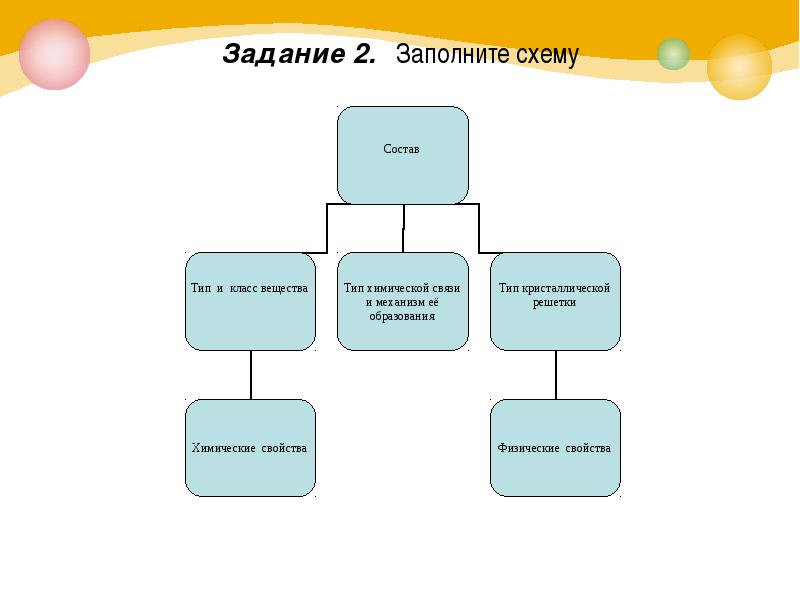
Проверим заполнение схемы

Задание 3. Перечислить условия смещения химического равновесия вправо (→) в следующих реакциях: а) N2 + 3Н2 ↔ 2 NН3 + Q _________________________________б) N2 + О2 ↔ 2 NО - Q_________________________________

Круговорот азота с природе
Применение азота

Применение азота важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.

Решение задач Задача 1. Сколько грамм кальция потребуется для взаимодействия с 28 граммами азота?Задача 2. Сколько литров воздуха, содержащего 78 % азота, потребуется для получения 100 литров аммиака?Задача 3. Сколько грамм нитрида алюминия можно получить из 54 грамм алюминия и 66,2 литров азота?

 |
|
|
 Скачать 445 b.
Скачать 445 b.











