Урок упражнение по теме: «Металлы»
 Скачать 44.84 Kb. Скачать 44.84 Kb.
|
| Урок – упражнение по теме: « Металлы». Цели: 1. Повторить с учащимися положение металлов в ПСХЭ, особенности строения их атомов и кристаллов, металлическую химическую связь и кристаллическую металлическую решетку. 2. Обобщить знания учащихся, полученные ранее при рассмотрении общих химических свойств металлов; способах получения металлов ( пирометаллургии, гидрометаллургии, электрометаллургии); о коррозии металлов, классификации коррозионных процессов и способах защиты от коррозии. 3. Развивать логические операции мышления при обобщении знаний и конкретизации общих свойств металлов для отдельных представителей этого класса простых веществ. Оборудование: таблицы «Коррозия металлов», «Способы защиты от коррозии», карточки – схемы, карточки с индивидуальными заданиями. Тип урока: повторительно – обобщающий. Ход урока. I. Организационный момент. Ребята! Сегодня наш урок – упражнение пройдет в виде аукциона знаний по теме «Металлы». На уроке, выполняя задания, мы повторим и систематизируем все свойства металлов и их соединений. II. Повторение и обобщение. 1) Фронтальный опрос. Периодическая система химических элементов Д. И. Менделеева поможет нам обобщить свойства металлов как химических элементов.
Металлы – это химические элементы, атомы которых отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.
(Левый нижний угол от диагонали бор – астат).
(Работа с ПСХЭ).
(Восстановители).
(Выступления учащихся).
(Металлическая).
(Металлическая).
(Металлический блеск, пластичность, высокая теплопроводность, электропроводимость, твердость, прочность, магнитные свойства). 2) Письменные задания. 1. Металлы как восстановители очень активные, поэтому, используя опорную схему в общем виде, вспомним химические свойства металлов.  Неметалл Неметалл  О2 О2 Металл + Н2 О Металл + Н2 О  Оксид Металла Оксид Металла  Кислота Кислота Соль СольЗапишите химические свойства для элемента кальций и укажите условия протекания реакций. t Са + Н2 = СаН2 t 2Са + О2 = 2СаО 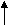 Са + 2Н2О = Са(ОН) + Н2 t Са + СuО = СаО + Сu 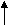 Са + 2НСI = СаСI2 + Н2 Fe + СuSO4 = FeSO4 + Сu Последнее свойство основано на положении металлов в электрохимическом ряду напряжений металлов. Каждый металл способен вытеснить из растворов солей те металлы, которые стоят в ряду напряжений после него. 1. Металлы входят в состав соединений, составьте схему, используя только ключевое слово.   Вещества Вещества        2. Запишите формулы веществ, расставив их на соответствующие места в схеме, отражающей классификацию неорганических веществ. (Na, СаО, КОН, S, HCI, СаSO4) 2. Перед вами таблица с формулами веществ. Пройдите, составив схему реакций, от одного вещества в задании к другому. Покажите различные пути: а) от Na до NaOH; б) от Na2O до Na2SO4.
а)I) 2Na + 2H2O = 2NaOH + H2    II) Na Na2O2 Na2O NaOH II) Na Na2O2 Na2O NaOH1) 2Na + O2 = Na2O2 2) Na2O2 + 2Na = 2Na2O 3) Na2O + H2O = 2NaOH б   ) I) Na2O NaOH Na2SO4 ) I) Na2O NaOH Na2SO41) Na2O + H2O = NaOH или Na2O + H2SO4 = Na2SO4 + H2O 2) 2NaOH + H2SO4 = Na2SO4 + 2H2O 3. На рисунке изображены пересекающиеся понятия. В круг 1 входят вещества, проявляющие основные свойства, а в круг 2 – вещества, проявляющие кислотные свойства. Разместите в этих кругах формулы: Na2O, AI(OH)3, KOH, ZnO, SO3, AI2O3, CaO, N2O5, Mg(OH)2, H2SO4. Какую область на данном рисунке могут занять оставшиеся формулы, объясните их свойства. (Амфотерные оксиды и гидроксиды – область пересечения).    Однако, говоря о свойствах металлов, нельзя забывать о способности металлов реагировать с веществами окружающей среды и образовывать на поверхности особые соединения, обладающие совершенно особыми свойствами, чем сами металлы.
(Коррозия металлов). К   оррозия металлов оррозия металлов   По месту образования По характеру По месту образования По характеру Сплошная местная химическая электрохимическая
(шлифование, применение легированных сплавов, нанесение защитных покрытий, электрохимическая защита (анодная, катодная), применение ингибиторов). Дополнительные сведения. Изделия из металлов подвергаются коррозии. Не щадит она и памятники архитектуры, так например, Эйфелева башня – символ Парижа, изготовлена из обычной стали и неотвратимо ржавеет и разрушается и только постоянная химиотерапия (лечение химическими веществами) помогают её сохранять. Башню красили уже 18 раз, отчего её масса (9 000 т) каждый раз увеличивалась на 70 тонн. Вопрос – задание: С какой целью поверхность цистерн для хранения нефтепродуктов (бензина, керосина) окрашивают «серебрином» - смесью алюминиевой пудры с одним из растительных масел? III. Итог. Домашнее задание. §18 №6; из формулы соли сульфата железа (III) составить формулы других соединений. |