Общие понятия о коррозии, способы защиты металлов
 Скачать 66.46 Kb. Скачать 66.46 Kb.
|
ХИ9-У-13 Тема урока: Общие понятия о коррозии, способы защиты металлов. Образовательные цели: сформировать представление о коррозии металлов как самопроизвольном окислительно-восстановительном процессе, её значении, причинах, механизме и способах защиты; показать влияние на скорость коррозии таких факторов, как природа веществ, температура и присутствие катализатора (ингибитора). Развивающие: развить умение проведения химического эксперимента с соблюдением правил техники безопасности, строить логические цепочки и выводы из наблюдений, прогнозировать решение некоторых проблем. Воспитательные: совершенствовать коммуникативные умения в ходе коллективного обсуждения, продолжать формировать убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире. Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод Тип урока: изучение нового материала. Оборудование: компьютер, мультимедиа, таблицы: «Коррозия металлов», «Защита металлов от коррозии», опорный конспект «Коррозия металлов», презентация к уроку. Реактивы для выполнения лабораторных опытов:10% раствор NaOH, дистиллированная вода, 1% раствор красной кровяной соли, железные гвозди, медная проволока, цинковая пластина, 5 пробирок Подготовка демонстрационного опыта: В семь пробирок наливаем равные объемы раствора поваренной соли, добавляем по 1-2 капли фенолфталеина. В пробирки помещаем зачищенные кусочки: 1. алюминия, 2. железа, 3. меди, 4. цинка, 5. сплетенных алюминиевой и медной проволоки, 6. железный гвоздь обвитый медной проволокой, 7. цинковую полоску, обвитую медной проволокой пробирка №2 – железный гвоздь в контакте с медной проволокой в растворе хлорида натрия пробирка №3- железный гвоздь в контакте с цинком в растворе хлорида натрия Ход урока 1. Вступительное слово учителя Урок начинается с чтения сказки, главным персонажем которой является трехголовый дракон. Одна голова следит за сбором дани, из пасти второй - извергается пламя, а третья – устраивает наводнения. В сказке трехголовый дракон олицетворяется с процессом коррозии. Коррозией металлов называют самопроизвольный процесс разрушения металлов и изделий из них под воздействием окружающей среды. Блок 1 ОК. По характеру разрушения металла различают коррозию сплошную, язвенную и точечную. Демонстрация фотографий коррозии металлов
Me0 – ne = Me+n Блок 2 . Влияние второй головы дракона. Химическая (газовая) коррозия происходит в сухих газах, при полном отсутствии влаги Демонстрационный опыт 1: Роль кислорода в коррозии. В колбу помещены железные стружки. Колба закрыта резиновой пробкой с П-образной трубкой, конец которой помещен в стакан с подкрашенной водой. Вода поднимается по трубке вверх. Демонстрационный опыт 2. Щелочной или щелочноземельный металл, лишеный керосиновой защиты. Лабораторный опыт 1. Прокаливание медной пластины. 2Cu + O2 → 2CuO (запись в тетради и на доске) восстановитель Cu0 – 2e → Cu2+ | 2| процесс окисления окислитель O20 + 4e → 2O2- | 1| процесс восстановления Вывод: Кислород оказывает огромное влияние на процесс коррозии, являясь одним из наиболее агрессивных ее факторов. Блок 3 . Влияние третьей головы дракона. Электрохимическая коррозия - разрушение металла в среде электролита с возникновением электрического тока. Символ Парижа – Эйфелева башня неизлечима больна, ржавеет и разрушается. В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3 А «Железная колонна» (Дели) на протяжении не одного десятка лет колонна является предметом оживленных споров между учеными, которые даже в эпоху высоких технологий не в состоянии объяснить, почему за свою 1600-летнюю историю она практически не поддалась атмосферным воздействиям. Металлы можно расположить в ряд, который начинается с химически активных и заканчивается наименее активными благородными металлами: При электрохимической коррозии поток электронов направлен от более активного металла к менее активному проводнику и более активный металл коррозирует. Лабораторные опыты 2-6:
Вывод: Железо слабо коррозирует, в чистой воде коррозия идет медленно, так как это слабый электролит.
Вывод: коррозии выше, чем в первом случае, следовательно хлорид натрия увеличивает скорость коррозии.
Вывод: Идет сильная коррозия железного гвоздя в контакте с медной проволокой в растворе хлорида натрия.
Вывод: при контакте железа с цинком коррозия не наблюдается.
Вывод: железный гвоздь, опущенный в раствор хлорида натрия, к которому добавили гидроксида натрия, не коррозирует. Коррозия металлов в кислой среде Запись в тетрадях: 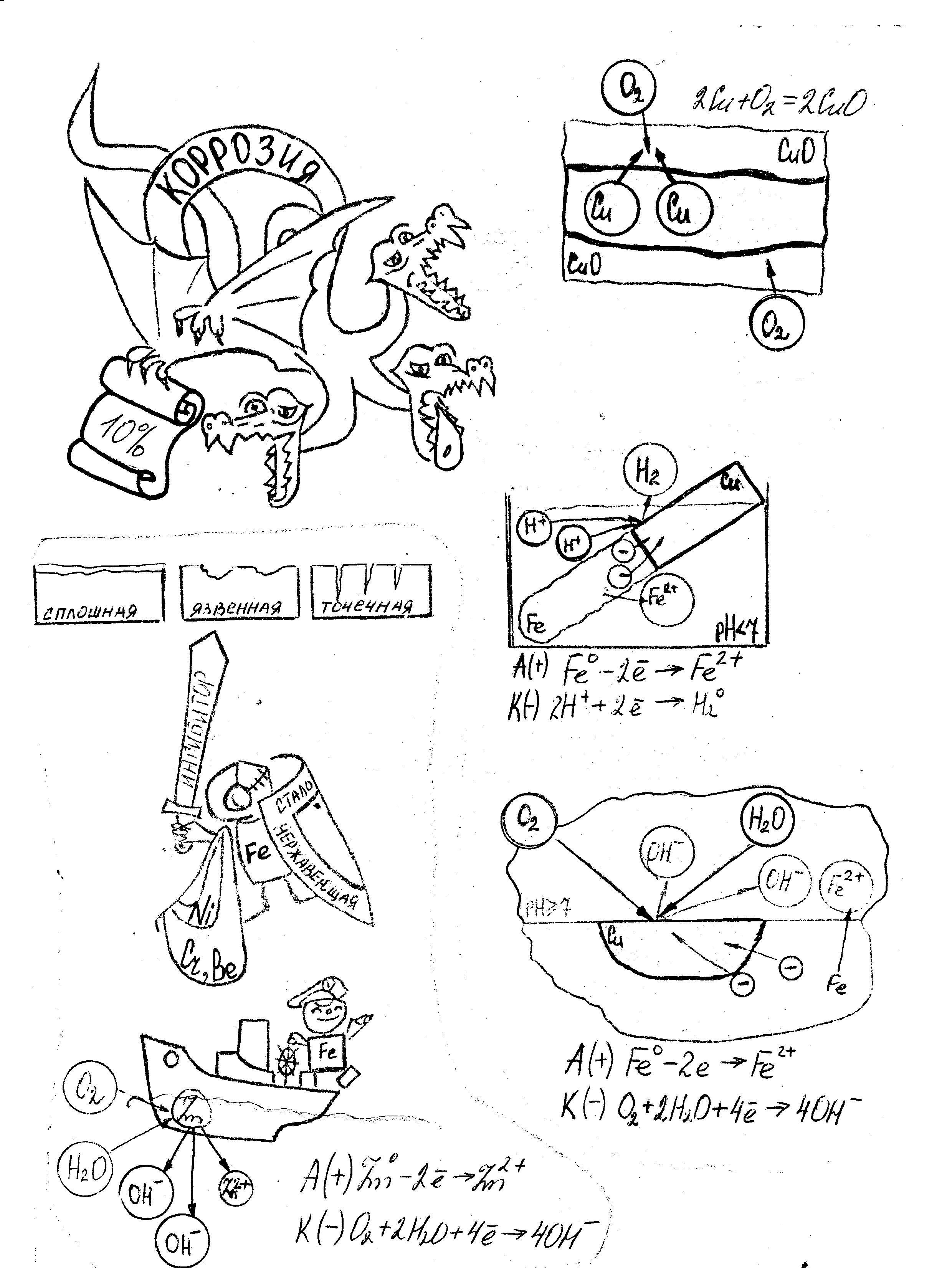 А(+) Fe0 – 2e → Fe2+ К(-) 2H+ + 2e → H20 Fe0 + 2H+ → Fe2+ + H20 Вывод: Окислителем являются ионы водорода. Скорость электрохимической коррозии зависит от природы примесей в металле, природы электролита . Коррозия металлов в нейтральной и (или) щелочной среде  А(+) Fe0 – 2e → Fe2+ К(-) O2+2H2O+4e →4OH 2Fe0 + O2 + 2H2O→ 2 Fe(OH)2 4Fe(OH)2 + O2 + 2H2O→ 4 Fe(OH)3 Вывод: Кислород – окислитель  Блок 4: Способы защиты от коррозии 1.Защитные поверхностные покрытия: а. Металлическое (цинк, олово, никель, свинец) б. Неметаллические (лаки, краски, эмали…) 2.Создание сплавов с антикоррозионными свойствами – легирование металлов (+ никель, кобальт, хром, вольфрам…) 3. Введение ингибиторов 4. Протекторная защита 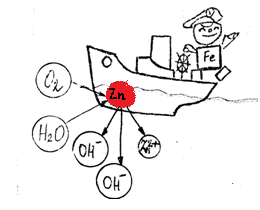 А(+) Zn0 – 2e → Zn2+ К(-) O2+2H2O+4e →4OH 2Zn0 + O2 + 2H2O→ 2 Zn(OH)2 III. Первичное закрепление материала Самостоятельная работа «Коррозия металлов» по вариантам. Вариант №1
Вариант №2
Вариант №3
Вариант №4
IV. Подведение итогов урока Д/з: §10, упр.6 РЯД НАПРЯЖЕНИЯ МЕТАЛЛОВ Li, Rb, К, Ва, Sr, Са, Mg, Al, Be, Mn, Zn, Cr, Ga, Fe, Cd, Tl, Co, Ni, Sn, Pb, H, Sb, Bi, As, Cu, Hg, Ag, Pd, Pt, Au. 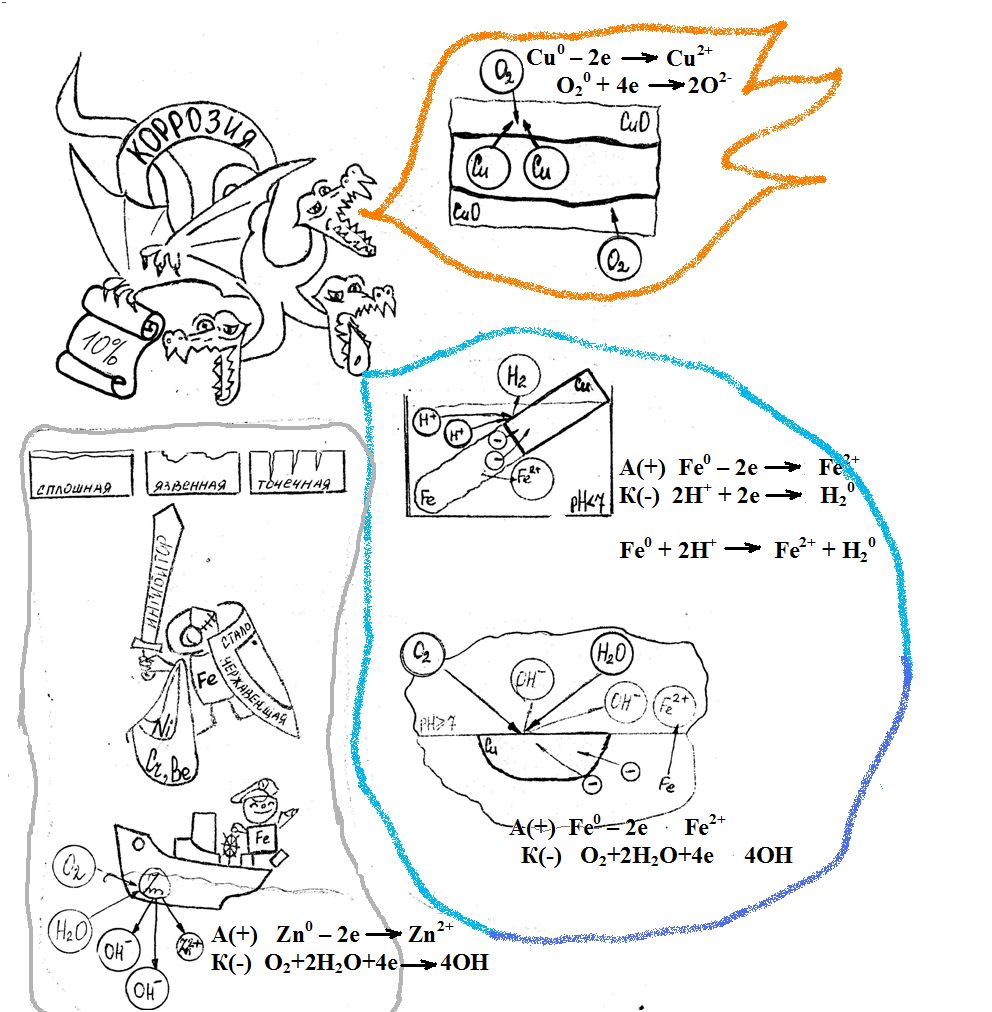 |



