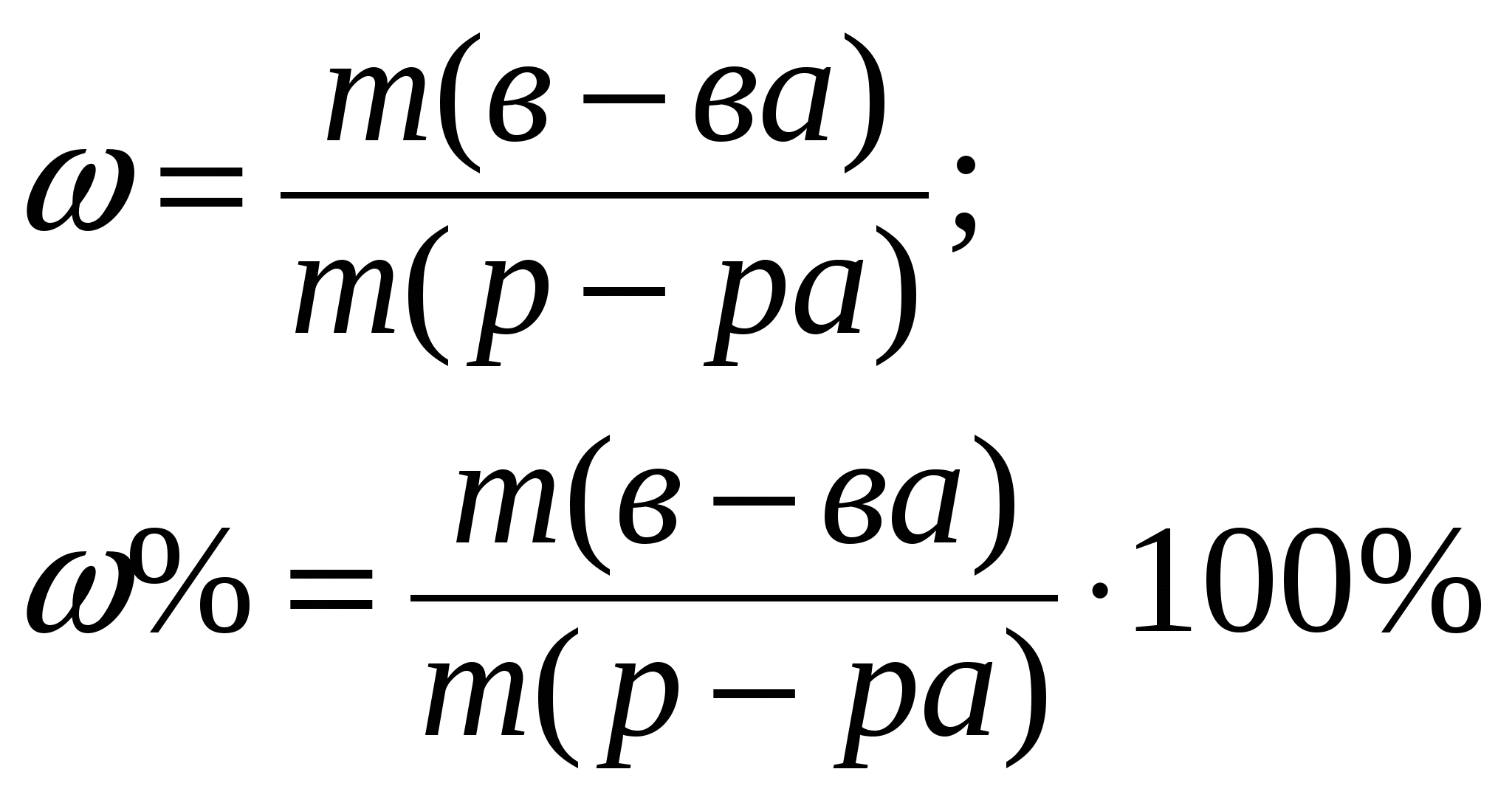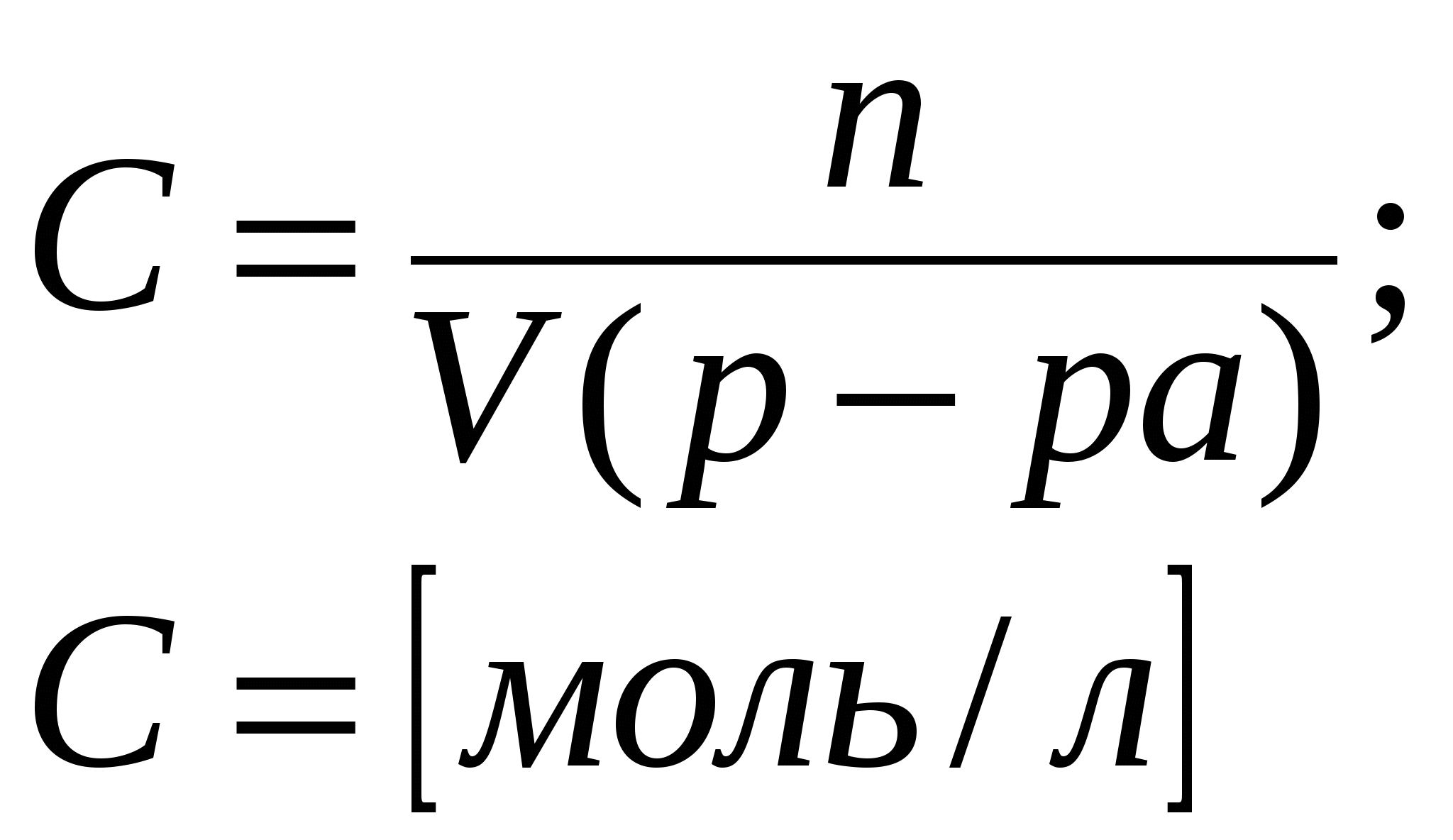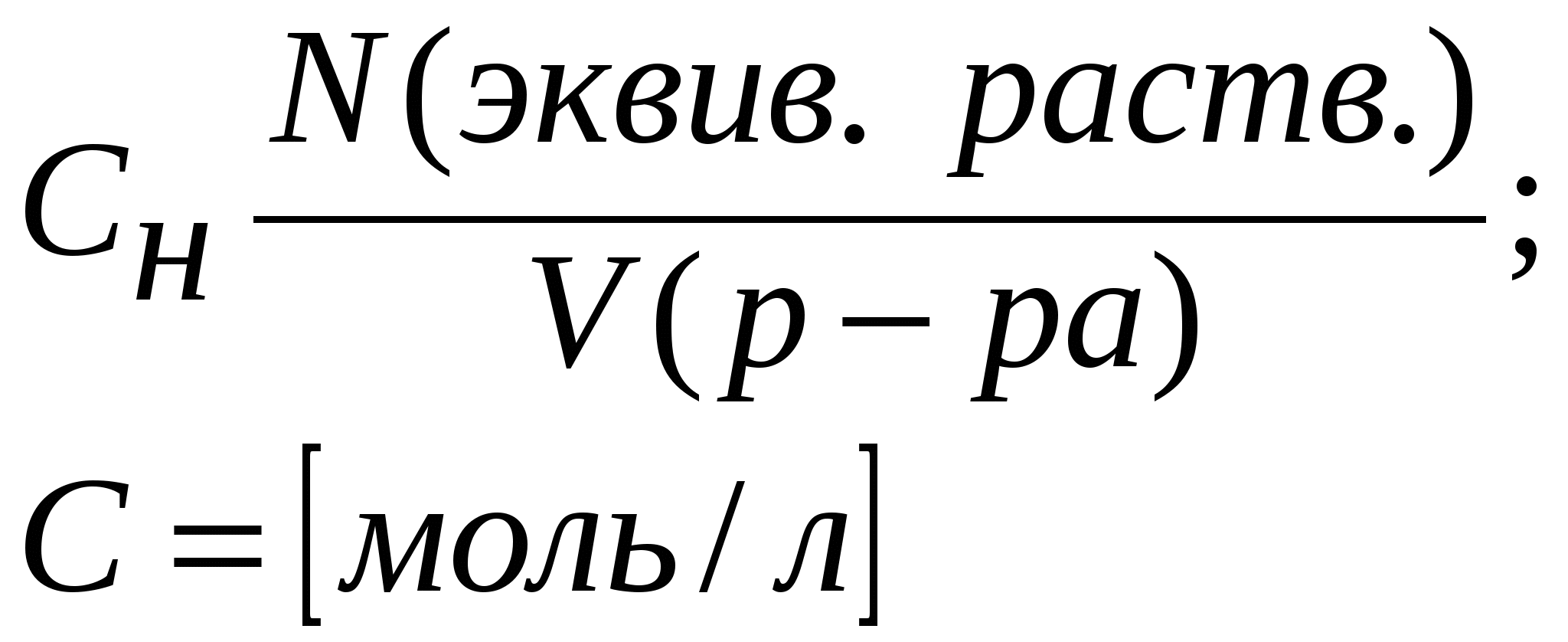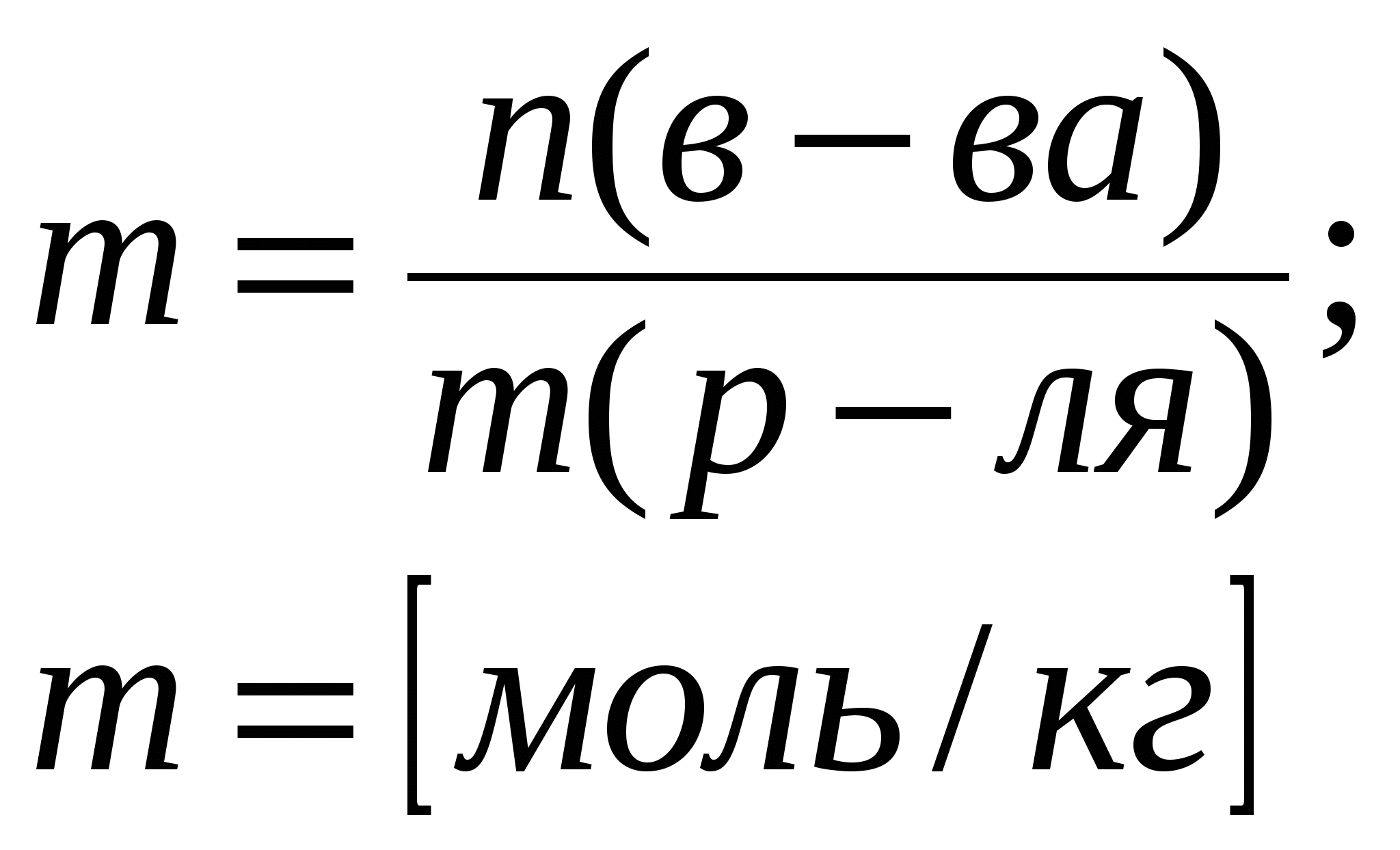Элективный курс по химии по теме: «Решение расчетных задач»
 Скачать 419.04 Kb. Скачать 419.04 Kb.
|
1 2
Тематический план. 11 класс (1 ч. в неделю, всего 34 ч.)
Литература для учащихся 1. Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. Химия. 10 класс: Учеб. для общеобразовательных учреждений – М.: Дрофа, 2009. 2. Габриелян О. С., Лысова Г. Г. Химия. 11 класс: Учеб. для общеобразовательных учреждений – М.: Дрофа, 2009. 3. Егоров А. С. Самоучитель по решению химических задач (для учащихся и абитуриентов) – Ростов н/Д: Феникс, 2007. 4. Единый государственный экзамен 2007. Химия. Учебно-тренировочные задания для подготовки учащихся/ ФИПИ – М.: Интеллект-Центр, 2007. 5. Никитюк Т. В., Никитюк А. М., Остроумов И. Г. Химия. Тесты для повторения и подготовки – Саратов: Лицей, 2006. 6. Репетитор по химии /под ред. Егорова А. С./ – Ростов н/Д: Феникс, 2007. 7. Хомченко Г. П., Хомченко И. Г. Сборник задач и упражнений по химии для средней школы – М.: Новая волна, 2006. 8. Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в ВУЗы – М.: Новая волна, 2006. Литература для учителя 1. Артемов А. В. Школьные олимпиады. Химия. 8-11 классы – М.: Айрис-пресс, 2007. 2. Врублевский А. И. Задачи по химии с примерами решений для школьников и абитуриентов – Мн.: ООО «Юнипресс», 2006. 3. Врублевский А. И., Барковский Е. В. Задачи по органической химии с примерами решений для школьников и абитуриентов – Мн.: ООО «Юнипресс», 2005. 4. Выполнение заданий и решение задач повышенной сложности с комментариями и ответами для подготовки к единому государственному экзамену по химии (Алгоритмы выполнения заданий и способы решения задач)/ Сост. Денисова В. Г. – Волгоград: Учитель, 2004. 5. Дзуцова Д. Д. Окислительно-восстановительные реакции. – М.: Дрофа, 2005. 6. Кузьменко Н. Е., Еремин В. В. 2400 задач для школьников и поступающих в ВУЗы. – М.: Дрофа, 2008. 7. Кузьменко Н. Е. Начала химии. Современный курс для поступающих в ВУЗы. – М.: Экзамен. Оникс 21 век, 2009. 8. Новошинский И .Н., Новошинская Н. С. Типы химических задач и способы их решения. 8-11 классы. – М.: ООО Оникс. Мир и образование, 2008. 9. Рябов М. А. 375 проверочных заданий по химии для поступающих в ВУЗы. – М.: Компания «Евразийский регион». Российский Университет Дружбы Народов. Уникум-Центр, 2006. 10. Слета Л. А., Черный А. В., Холин Ю. В. 1001 задача по химии с ответами, указаниями, решениями. – М.: Илекса, 2005. Приложение 1 Алгоритм решения задач на вычисление массы (объема) продукта реакции, если одно из исходных веществ дано в избытке.
Алгоритм решения задач на вычисления, связанные с использованием понятия «выход продукта реакции».
Алгоритм решения задач на вычисление массы (объема) продукта реакции, если исходное вещество содержит примеси.
Алгоритм решения задач на нахождение молекулярной формулы вещества по относительной плотности и массовой доли элемента в соединении
Алгоритм решения задач на нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания
Приложение 2 (10-й класс) Решение задач по разделу 3: «Количественная характеристика растворов». СПРАВОЧНИК ФОРМУЛ ДЛЯ РЕШЕНИЯ ЗАДАЧ ПО ТЕМЕ «КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ»
Задача 1. Сероводород объемом 14 мл растворили в воде массой 500 г (н.у.). Вычислите массовую долю сероводорода в растворе. Решение. 1. Вычислим m (H2S) в 14 мл: 2. Вычислим массу раствора: m(p-p) = m(в-ва) + m(р-ля) = 500 + 0,0213 = 500,0213 г. 3. Вычислим массовую долю вещества в растворе: Ответ: 0,0000424. Задача 2. Рассчитайте мольные доли спирта и воды в 96%-ном растворе этилового спирта. Решение. 1. Вычислим количества вещества спирта и воды, содержащихся в 96%-ном растворе. 100 г р-ра содержит 96 г спирта и 4 г воды. N = m/M n (спирта) = 96/46 = 2,09 моль. n (воды) = 4/18 = 0,222 моль. 2. Вычислим мольную долю каждого вещества в растворе: N(x) = n(x)/(n(x) + n(s)) N (спирта) = 2,09/(2,09 + 0,222) = 0,9. N (воды) = 0,222/(2,09 + 0,2220 = 0,096. Ответ: 0,9; 0,096. Задача 3. В растворе объемом 500 мл содержится хлорид магния массой 9,5 г. Определите молярную и нормальную концентрации растворенного вещества. Решение: 1. Определим молярную концентрацию раствора: C(MgCl2) = 2. Для определения нормальной концентрации раствора необходимо определить молярную массу эквивалента соли: а затем нормальную концентрацию раствора: Ответ: С(MgCl2) = 0,2 М; Сэкв(MgCl2) = 0,4 н. Задача 4. Вычислите, какой объем раствора с массовой долей серной кислоты 70% ( = 1,622 г/мл) нужно взять для приготовления растворов объемом 25 мл с концентрацией H2SO4: а) 2 М; б) 2 н. Решение: 1. Находим массу серной кислоты, которая содржится в растворе объемом 25 мл с концентрацией 2 М H2SO4. Из формулы С(H2SO4) = 2. Вычисляем массу раствора с массовой долей серной кислоты 70%, в котором будет содержаться Из формулы 3. Определяем необходимый объем раствора: Задачу можно решить в одно действие. Из формулы 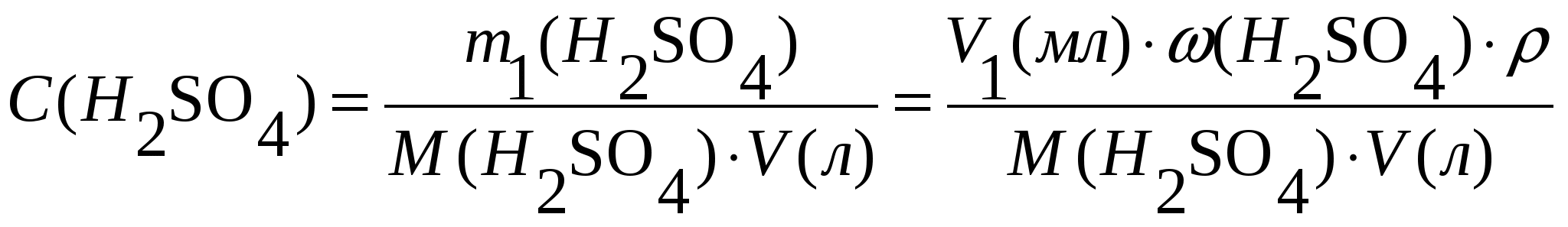 следует, что 4. Определяем необходимый объем раствора для приготовления 25 мл раствора с концентрацией 2 н. Из формулы 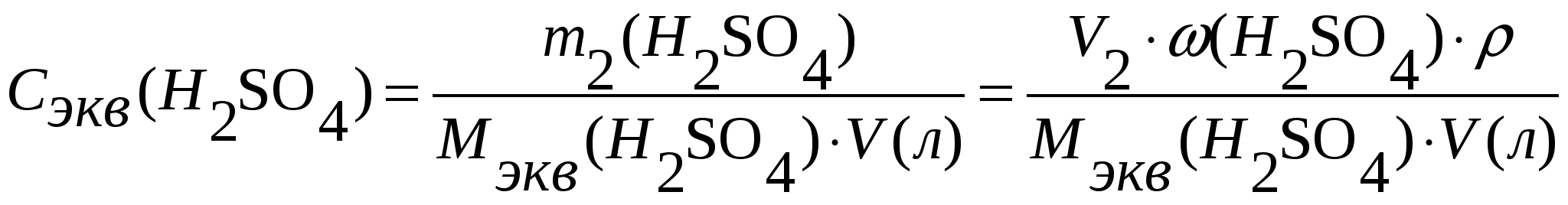 следует, что Ответ: V1 = 4,32 мл; V2 = 2,16 мл. Задача 5. Сколько граммов сульфата калия выпадет в осадок из 400 г раствора, насыщенного при 800С, при охлаждении его до 200С? Растворимость сульфата калия составляет 21,4 г при 800С и 11,1 при 200С. Решение. 1) Вычислим массу вещества в 400 г раствора при 800С. Растворимость показывает, какая максимальная масса вещества может быть растворена в 100 г растворителя. Таким образом, 121,4 г раствора содержат 21,4 г вещества; 400 г раствора содержат х г вещества. Х = 70,51 г. 2) Вычислим массу воды в исходном растворе. M(H2O) = m(р-ра) – m(в-ва) = 400 – 70,51 = 329,49 г. 3) Вычислим массу вещества в растворе, охлажденном до 200С. 100 г воды содержат 11,1 г вещества; 329,49 г воды содержат y г вещества. Y = 36,57 г. 4) Вычислим массу вещества, выпавшего в осадок. m(осадка) = m(в-ва)исх – m(в-ва)ост = 70,51 – 36,57 = 33,94 г. Ответ: 33,94 г. Приложение 3 (10-й класс) к занятию 31 «Решение контрольных задач по материалу курса». А-1 В результате реакции: 2C4H10(г) + 13O2(г)→ 8CO2(г) + 10H2O(г). Образовалось 5 моль оксида углерода (). Объем кислорода (н.у.), который потребуется для смешивания метана равен: 1) 180л 2)182л 3)212л 4)160л А-2 При взаимодействии16,25г цинка с разбавленной соляной кислотой выделится газ, объем которого (н.у.) равен 1) 5,6л 2) 8,4л 3) 11,2л 4) 16,8л А-3 Для полного гидрирования 10,5г пропена потребуется водород (н.у.) объемом: 1) 2,8л 2) 5,6л 3) 8,4л 4) 11,2л Часть В. В-1 Масса метилового эфира масляной кислоты, полученного при взаимодействии 48г метилового спирта и 100г 44% раствора масляной кислоты, равна ___ г. В-2 При действии избытка серной кислоты на 780г технического хлорида натрия, содержащего 25% примесей, выделится хлороводород объемом (н.у.) ___ л. В-3 Масса хлорида железа (), образующегося при взаимодействии 16г оксида железа () с 20г 73% раствора соляной кислоты, равна ___ г. часть С. С-1 Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 2,24л (н.у.) сероводорода через 250г 10%-ного раствора сульфата меди. С-2 Гидрид кальция внесли в избыток раствора соляной кислоты (масса раствора кислоты 150г, массовая доля HCl 20%). При этом выделилось 6,72л (н.у.) водорода. Рассчитайте массовую долю хлорида кальция в полученном растворе. Критерии оценивания. Оценка “3” – выполнено 2 задания из части А. Оценка “4” – выполнено 1 задание из части А и одно из части В Оценка “5” – выполнено 1 задание из части С или два задания из части В Приложение 4 (11-й класс к занятиям 31-33разделу 5: «Решение комбинированных и усложненных задач по химии» Задача № 1 Вычислите массу метилового эфира масляной кислоты, полученного при взаимодействии 48 г. метилового спирта и 100 г. 44 % раствора масляной кислоты. Д  ано: Решение: ано: Решение: m(CH3OH)=48г 1.5 моль 0.5 моль 0.5 моль mр-ра(C3H7COOH)=100г CH3OH+C3H7COOH→C3H7-C-O-О-CH3+H2O ω%(C3H7COOH)=44% 1 моль 1 моль  m(эфира) - ? m(эфира) - ?mр-ра(C3H7COOH)→m(C3H7COOH)→ n(C3H7COOH) n(эфира)→m(эфира) (CH3OH)→n(CH3OH) n(CH3OH) = m/M=48/32 = 1,5моль-избыток M(CH3OH) = 12+4+16 = 32 г/моль m(C3H7COOH) = mр-ра* ω%(C3H7COOH)/100% = = 100*44/100 = 44г n(C3H7COOH) = m/M = 44/88 = 0,5 моль M (C3H7COOH) = 12•4+8+16•2 = 88 г/моль n(эфира) = 0,5моль M (эфира) = 102г/моль m(эфира) = 102г/моль•0,5моль = 51г Ответ:m(эфира) = 51г. Задача № 2 Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 2,24л (н.у.).сероводорода через 250г 10% раствора сульфата меди. Д  ано: Решение: ано: Решение:V(H2S)=2,24л СuSO4+H2S = CuS↓+H2SO4 mр-ра(СuSO4)=250г 1моль 1моль 1моль ω  %(СuSO4)=10% V(H2S)→n(H2S) %(СuSO4)=10% V(H2S)→n(H2S) n(H2SO4)→m(H2SO4)→ω%(H2SO4)  mр-ра(CuSO4)→m(CuSO4)→n (CuSO4) mр-ра(CuSO4)→m(CuSO4)→n (CuSO4)ω%(H2SO4)-? n(H2S)=2,24/22,4=0,1моль m(CuSO4)=250•10/100=25г n (CuSO4)=m/M=25/160=0,156моль-избыток M(CuSO4)=160г/моль n (H2SO4)=n(H2S)=0,1моль m (H2SO4)=n•M = 0,1•98=9,8г M(H2SO4)=98г/моль ω% (H2SO4)=m(H2SO4)/mр-ра•100% mр-ра2=mр-ра(H2SO4)+m(H2S)-m(CuS) n(CuS)=n(H2S)=0,1моль m(СuS)=0,1•96=9,6г M(CuS)=96г/моль m(H2S)=n•M=0.1•34=3,4г mр-ра2=250+3,4-9,6=243,8г ω% (H2SO4)=9,8/243,8=4% Ответ: ω% (H2SO4)= 4% Задача № 3 Напишите уравнения реакций, соответствующие следующей последовательности превращений: 1       ). КАlО2 X1 2). Fe(OH)3 X1 ). КАlО2 X1 2). Fe(OH)3 X1  Х2 А1(ОН)3 Х2 FeS Х2 А1(ОН)3 Х2 FeSНазовите неизвестные вещества. Решение: 1) Алюминат калия КАlO2 взаимодействует с кислотой НС1 с образованием хлоридов калия и алюминия. При их обработке расчетным количеством щелочи осаждается гидроксид алюминия, который растворяется в избытке КОН. Если отфильтровать и прокалить тетрагидроксоалюминат КА1(ОН)4, получается исходный КАlO2. КА1О2 + 4НС1 = КС1 +А1С13 + 2Н20; А1С13 + ЗКОН = А1(ОН)3 + ЗКС1; А1(ОН)3 + КОН = КА1(ОН)4; КА1(ОН)4 = КАlO2 + 2Н2О (прокаливание). 2) Гидроксид железа (III) при прокаливании с углем восстанавливается до металлического железа. Железо при нагревании с серой образует сульфид железа (II). Этот сульфид разлагается соляной кислотой с образованием хлорида двухвалентного железа. Едкие щелочи в отсутствие воздуха осаждают из раствора раствора хлорида железа(II) гидроксид железа (II) , который быстро окисляется на воздухе в гидроксид Fe(OH)3. 2Fe(OH)3 + 2С = 2Fe + CO2 + СО + ЗН2О, X1 = Fe; Fe + S = FeS; FeS + 2HC1 = FeCl2 + H2S, X2 = FeCl2; 4FeCl2 + 8NaOH + O2 + 2H2O = 4Fe(OH)3 + 8NaCl. F  e2+ - e —> Fe3+ 4 e2+ - e —> Fe3+ 4O2 + 2H2O + 4e —> 40Н-- 1 Задача № 4 Определите массу кристаллогидрата Cr2(SO4)3 *18 H2O и раствора с массовой долей Cr2(SO4)3 0,15, которые надо взять для приготовления раствора с массовой долей Cr2(SO4)3 0,2 и массой 795г. Решение: для решения задачи можно использовать правило смешения. Выбираем для расчетов образец кристаллогидрата кол-вом в-ва 1 моль. Из формулы кристаллогидрата следует: V (Cr2 (SO4)3) = V (Cr2(SO4)3 * 18 H2O)= 1моль, М (Cr2(SO4)3)=V * М=392г М (Cr2(SO4)3)=52*2+3*32+12*16=104+96+192=392г/моль М (Cr2(SO4)3 * 18 H2O)= V * М=716гМ(Cr2(SO4)3 * 18 H2O)=392+324=716 г/мольОпределяем W(Cr2(SO4)3) в кристаллогидрате W(Cr2(SO4)3)= М (Cr2(SO4)3) = 392г =0,547 М (Cr2(SO4)3 * 18 H2O) 716г 0   ,547 0,05 ,547 0,05  0,2 0,20,15 0,347 Относительная масса кристаллогидрата равна 0,05 из общей относительной массы: Мр-ра(Cr2(SO4)3*18 H2O)=(М 0,5)/0,397=(795 0,5)/0,397=695г. Ответ: Мр-ра(Cr2(SO4)3*18 H2O)=695 г. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1 2