|
Металлы и их соединения
Контрольная работа «Металлы и их соединения» 1 вариант
Часть А.
При выполнении заданий этой части в бланке ответов под номером выполняемого вами задания поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
|
А1
|
Электронная формула атома магния:
1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
|
А2
|
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Na, Mg, Al 2) Al, Mg, Na 3) Ca, Mg, Be 4) Mg, Be, Ca
|
А3
|
Металл, обладающий самой высокой электропроводностью, - это
1) железо 2) медь 3) серебро 4) алюминий
|
А4
|
Наиболее энергично взаимодействует с водой:
1) калий 2) натрий 3) кальций 4) магний
|
А5
|
Гидроксид цинка взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
|
А6
|
Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) гальваностегия
|
Часть В.
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем получившуюся последовательность цифр перенесите в бланк ответов без пробелов и других символов.
|
В1.
|
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO2 1) Ca(OH)2 1) Ca(OH)2
Б) Ca(OH)2+ SO2 2) CaCO3+ H2O 2) CaCO3+ H2O
В) Ca + H2O  3) CaSO4+ H2O 3) CaSO4+ H2O
Г) Ca (HCO3)2 + Ca(OH)2 4) Ca(OH)2 + H2 4) Ca(OH)2 + H2
5) CaSO3 + H2O
6) CaCO3
|
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe FeCl3 FeCl3 Fe(OH)3 Fe(OH)3 Fe2O3 Fe2O3 Fe Fe FeCl2. Переход 4 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации. FeCl2. Переход 4 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции.
Контрольная работа «Металлы и их соединения» 2 вариант
Часть А.
При выполнении заданий этой части в бланке ответов под номером выполняемого вами задания поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
|
А1
|
Электронная формула атома алюминия:
1)1s22s22р1 2) 1s22s2 2p63s2 3) 1s22s2 2p63s23р1 4) 1s22s2 2p63s23p3
|
А2
|
В каком ряду химические элементы расположены в порядке увеличения их атомного радиуса?
1) Na, Mg, Al 2) Al, Mg, Na 3) K, Na, Li 4) Mg, Be, Ca
|
А3
|
Металл, обладающий самой высокой пластичностью, - это: 1) золото 2) медь 3) серебро 4) алюминий
|
А4
|
Не взаимодействует с раствором серной кислоты
1) цинк 2) серебро 3) никель 4) железо
|
А5
|
Оксид алюминия взаимодействует с каждым из двух веществ:
1) HCl и O2 2) КOH и H2О 3) HCl и KOH 4) NaNO3 и H2SO4
|
А6
|
В качестве восстановителя при выплавке чугуна в доменных печах используют
1) водород 2) алюминий 3) кокс 4) магний
|
Часть В.
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем получившуюся последовательность цифр перенесите в бланк ответов без пробелов и других символов.
|
В1.
|
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Fe + Cl2 1) Fe2(SO4)3 + H2O 1) Fe2(SO4)3 + H2O
Б) Fe + HCl 2) FeSO4 + H2O 2) FeSO4 + H2O
В) Fe2O3 + H2SO4  3) FeCl3 3) FeCl3
Г) Fe + CuSO4 4) FeCl2 + H2 4) FeCl2 + H2
5) FeSO4 + Cu
6) Fe2(SO4)3 + Cu
|
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca Ca(OH)2 Ca(OH)2 CaCO3 CaCO3 Ca(HCO3)2 Ca(HCO3)2  CaCl2 CaCl2 Ca(NO3)2. Переход 1 рассмотрите в свете ОВР; переходы 4 и 5 - с позиции электролитической диссоциации. Ca(NO3)2. Переход 1 рассмотрите в свете ОВР; переходы 4 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 24,15г технического натрия, содержащего 5% примесей, с водой было получено 8,96л водорода (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Контрольная работа «Металлы и их соединения» 3 вариант
Часть А.
При выполнении заданий этой части в бланке ответов под номером выполняемого вами задания поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
|
А1
|
Электронная формула атома железа:
1) 1s22s2 2p63s2 3р6 2) 1s22s2 2p63s2 3р64s23d6 3) 1s22s2 2p63s2 3р64s23d5 4) 1s22s2 2p63s2 3р64s23d104p6
|
А2
|
В каком ряду химические элементы расположены в порядке ослабления металлических свойств?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) K, Ca, Be
|
А3
|
Самый легкоплавкий металл – это: 1) цезий 2) ртуть 3) алюминий 4) железо
|
А4
|
Вытеснит свинец из раствора нитрата свинца (II): 1) медь 2) цинк 3) калий 4) серебро
|
А5
|
Гидроксид железа (III) взаимодействует с каждым из двух веществ
1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) KCl и H2SO4
|
А6
|
Нельзя получить водородотермией
1) вольфрам 2) медь 3) натрий 4) хром
|
Часть В.
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем получившуюся последовательность цифр перенесите в бланк ответов без пробелов и других символов.
|
В1.
|
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Na + H2O 1) Fe(OH)2+ NaCl 1) Fe(OH)2+ NaCl
Б) Na2O + H2O 2) NaOH + H2 2) NaOH + H2
В) NaOH+ SO3 3) NaOH 3) NaOH
Г) NaOH + FeCl2 4) Fe(OH)3+ NaCl 4) Fe(OH)3+ NaCl
5) Na2SO3 + H2O
6) Na2SO4 + H2O
|
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al AlCl3 AlCl3 Al(OH)3 Al(OH)3 Al2O3 Al2O3  KAlO2 KAlO2  Al(NO3)3. Переход 1 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации. Al(NO3)3. Переход 1 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При термическом разложении 20 г известняка, содержащего 10% некарбонатных примесей, было получено 3,23л углекислого газа (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Контрольная работа «Металлы и их соединения» 4 вариант
Часть А.
При выполнении заданий этой части в бланке ответов под номером выполняемого вами задания поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа.
|
А1
|
Электронная формула атома калия:
1) 1s22s2 2p63s1 2) 1s22s2 2p63s2 3р64s2 3) 1s22s2 2p63s2 3р64s1 4) 1s22s2 2p63s2 3р64s23d1
|
А2
|
В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li, K, Rb 2) Al, Mg, K 3) Ca, Mg, Li 4) Be, Ca, K
|
А3
|
Самый тугоплавкий металл – это: 1) хром 2) медь 3) вольфрам 4) железо
|
А4
|
Не вытеснит медь из раствора сульфата меди(II): 1) железо 2) цинк 3) натрий 4) марганец
|
А5
|
Оксид калия взаимодействует с каждым из двух веществ:
1) HCl и CO2 2) NaOH и H2SO4 3) ВаO и KOH 4) NaNO3 и H2SO4
|
А6
|
Щелочные металлы получают: 1) электролизом растворов солей 2) электролизом расплавов солей
3) восстановлением коксом из оксидов 4) восстановлением водородом из оксидов
|
Часть В.
В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем получившуюся последовательность цифр перенесите в бланк ответов без пробелов и других символов.
|
В1.
|
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия
РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) Al + NaOH + H2O 1) Al(NO3)3 + H2 1) Al(NO3)3 + H2
Б) Al2O3 + NaOH 2) Al(NO3)3 + N2 + H2O 2) Al(NO3)3 + N2 + H2O
В) Al+ HNO3 3) NaAlO2 3) NaAlO2
Г) Al2(SO4)3 + KOH 4) NaAlO2 + H2 4) NaAlO2 + H2
5) NaAlO2 + H2O
6) Al(OH)3 + K2SO4
|
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe FeCl2 FeCl2 Fe(OH)2 Fe(OH)2  Fe(OH)3 Fe(OH)3 Fe2O3 Fe2O3 Fe(NO3)3 Переход 3 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации. Fe(NO3)3 Переход 3 рассмотрите в свете ОВР; переходы 2 и 5 - с позиции электролитической диссоциации.
C2. При взаимодействии 60г технического кальция, содержащего 2% примесей, с водой было получено 30л водорода (н.у.). Вычислите объемную долю выхода продукта реакции (в %)
Критерии оценивания
№ зада-ния
|
Проверяемые элементы содержания; умения и навыки
|
Уровень сложности
|
Количество баллов
|
А1
|
Знать положение металлов в Периодической системе химических элементов Д.И. Менделеева. Уметь составлять электронные формулы атомов металлов.
|
Б
|
1
|
А2
|
Знать закономерности изменения свойств элементов в периодах и главных подгруппах ПС. Уметь сравнивать свойства элементов.
|
Б
|
1
|
А3
|
Знать физические свойства металлов.
|
Б
|
1
|
А4
|
Знать общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Оценивать возможность протекания реакции, используя ряд напряжений металлов.
|
Б
|
1
|
А5
|
Знать химические свойства соединений щелочных, щелочно-земельных металлов, алюминия и железа.
|
Б
|
1
|
А6
|
Знать способы получения металлов.
|
Б
|
1
|
В1
|
Знать свойства металлов и их соединений. Уметь определять продукты реакций.
|
Б
|
4
|
С1
|
Знать свойства металлов и их соединений. Определять возможность протекания реакций; уметь составлять уравнения химических реакций в молекулярной и ионной формах; уметь определять значения степеней окисления элементов в соединениях, составлять электронные балансы и расставлять коэффициенты в ОВР
|
П
|
8
|
С2
|
Уметь анализировать условие задачи и решать её по известному алгоритму. Уметь рассчитывать массу и количество чистого вещества, если известна массовая доля примесей. Уметь рассчитывать массовую (или объемную долю) выхода продукта в % от теоретически возможного.
|
В
|
8
|
Итоговая оценка
|
0- 8 баллов:
«2»
|
9-16 баллов:
«3»
|
17 -21 баллов: «4»
|
22 -26 баллов: «5»
|
Всего
26 баллов
|
КЛЮЧ
Часть А Часть В
Вариант
|
А1
|
А2
|
А3
|
А4
|
А5
|
А6
|
1
|
2
|
2
|
3
|
1
|
2
|
2
|
2
|
3
|
2
|
1
|
2
|
3
|
3
|
3
|
2
|
4
|
2
|
2
|
2
|
3
|
4
|
3
|
3
|
3
|
3
|
1
|
2
|
Вариант
|
В1
|
1
|
6542
|
2
|
3415
|
3
|
2361
|
4
|
4526
|
Часть С.
1 вариант
|
2 вариант
|
С1. Элементы ответа:
2Fe +3Cl2=2FeCl3 1б.
Fe3+ + 3OH- = Fe(OH)3 2б.
2Fe(OH)3 = Fe2O3 + 3H2O 1б.
Fe2O3 + 3СО = 2Fe + 3СО2, баланс 2б.
Fe0 + 2H+ = Fe2+ + H20 2б.
|
С1. Элементы ответа:
Са + 2Н2О = Са(ОН)2 + Н2, баланс 2б.
Са(ОН)2 + СО2 = СаСО3 + Н2О, 1б.
СаСО3 + СО2 + Н2О = Са(НСО3)2, 1б.
Са(НСО3)2 + 2НCl = CaCl2 + 2СО2 +2Н2О, ионное, 2б.
CaCl2 + 2AgNO3= Ca(NO3)2 + 2AgCl, ионное, 2б.
|
С2. Элементы ответа:
1) Mg +2HCl = MgCl2 + H2 1 б.
2) m(Mg)= 12г * 0,95 = 11,4г 2 б.
3) 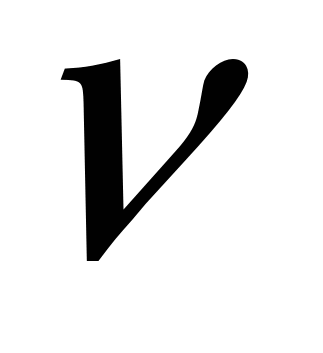 (Н2) = (Н2) =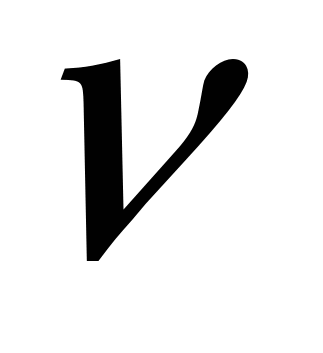 (Mg) = 11,4 /24 = 0,475моль 2 б. (Mg) = 11,4 /24 = 0,475моль 2 б.
4) V(H2)= 0,475 моль*22,4 л/моль = 10,64л теория 1б.
5)  выхода = 10л/10,64л = 0,94 или 94% 2б. выхода = 10л/10,64л = 0,94 или 94% 2б.
|
С2. Элементы ответа:
1) 2Na +2H2O = 2NaOH + H2 1 б.
2) m(Na)= 24,15г * 0,95 = 22, 94г 2 б.
3) 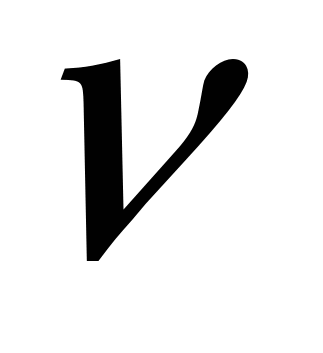 (Н2) =1/2 (Н2) =1/2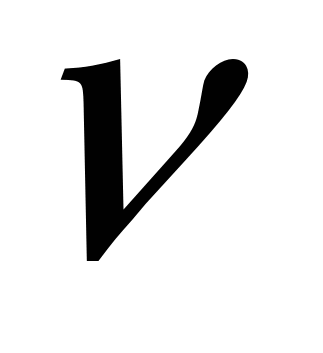 ( Na) = 22,94/46 = 0,5моль 2 б. ( Na) = 22,94/46 = 0,5моль 2 б.
4) V(H2)= 0,5 моль*22,4 л/моль = 11,2л теория 1б.
5)  выхода = 8,96л/11,2л = 0,8 или 80% 2б. выхода = 8,96л/11,2л = 0,8 или 80% 2б.
|
3 вариант
|
4 вариант
|
С1. Элементы ответа:
1) 2Al +3Cl2=2AlCl3, баланс, 2б.
2) AlCl3+ 3NaOH= Al(OH)3 + 3NaCl, ионное, 2б.
3) 2 Al(OH)3= Al2O3 + 3H2O, 1б.
4) Al2O3 + 2КОН = 2КAlO2+ H2O, 1б.
5) КAlO2+ 4HNO3 = Al(NO3)3+ KNO3 +2H2O, ионное, 2б.
|
С1. Элементы ответа:
Fe0 + 2HCl = FeCl2 + H20 , 1б.
Fe2+ + 2OH- = Fe(OH)2 , 2б.
4Fe(OH)2+ О2+ 2H2O =4Fe(OH)3, баланс, 2б.
2Fe(OH)3 = Fe2O3 + 3Н2О, 1б.
5) Fe2O3+ 6 HNO3 =2Fe(NO3)3 + 3Н2О, ионное,2б.
|
С2. Элементы ответа:
1) CaCО3 = СаО+ СО2 1 б.
2) m(CaCО3)= 20г * 0,90 = 18г 2 б.
3) 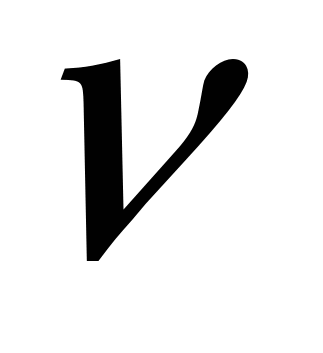 (СО2) = (СО2) =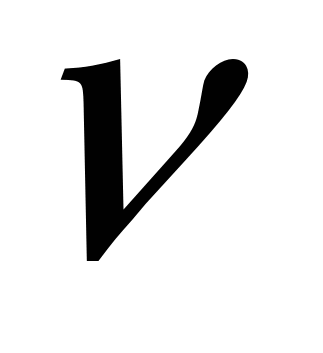 (CaCО3) = 18 /100 = 0,18моль 2 б. (CaCО3) = 18 /100 = 0,18моль 2 б.
4) V(СО2)= 0,18 моль*22,4 л/моль = 4,032л теория 1б.
5)  выхода = 3,23л/4,032л = 0,8или 80% 2б. выхода = 3,23л/4,032л = 0,8или 80% 2б.
|
С2. Элементы ответа:
1) Сa +2H2O = СаOH)2 + H2 1 б.
2) m(Сa)= 60г * 0,98 = 58,8г 2 б.
3) 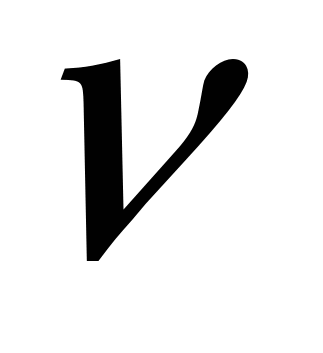 (Н2) = (Н2) =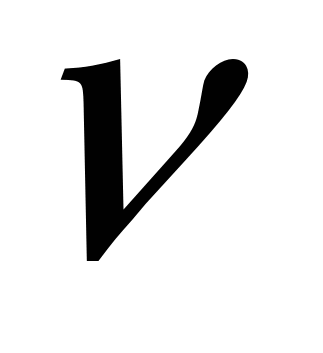 (Сa) = 58,8/40 = 1,47моль 2 б. (Сa) = 58,8/40 = 1,47моль 2 б.
4) V(H2)= 1,47 моль*22,4 л/моль = 32,93л теория 1б.
5)  выхода = 30л/32,93л = 0,91 или 91% 2б. выхода = 30л/32,93л = 0,91 или 91% 2б.
| |
|
|
 Скачать 137.77 Kb.
Скачать 137.77 Kb.