Получение и изучение свойств карбонилсодержащих соединений
 Скачать 105.39 Kb. Скачать 105.39 Kb.
|
| Лабораторная работа № 2. Тема: “Получение и изучение свойств карбонилсодержащих соединений”. Цель работы: формирование умений получать, а так же изучать, сравнивать и анализировать свойства альдегидов и кетонов на основе проведения химического эксперимента. Форма работы: индивидуально- парная. Характер работы: экспериментальный, частично- поисковый. Рекомендуемая литература: Габриелян О.С.Химия-10 (профил. уровень) стр.169-179 Контрольные вопросы:
Информационный опорный конспект «Оксосоединения» 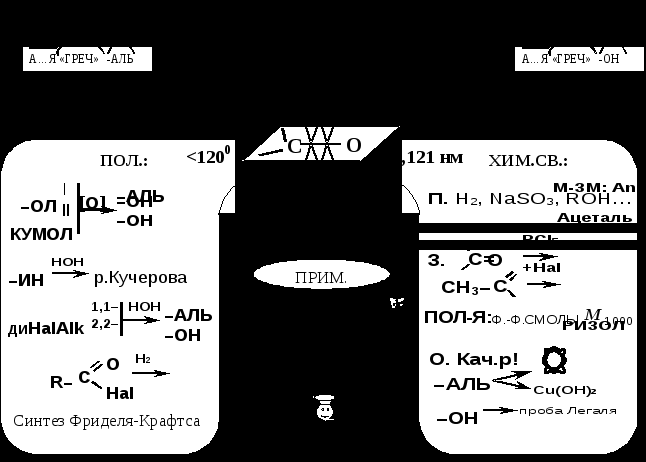 Проверка знаний:
Отчет к лабораторной работе № 2. Оборудование: ————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————— Реактивы: ——————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————————— Ход работы: Опыт № 1. Получение альдегидов. а) Получение формальдегида окислением метанола оксидом меди (11). Смачивают метанолом стенки сухой пробирки. Нагревают спираль из медной проволоки в пламени горелки до образования на ее поверхности черного налета оксида меди (11). Затем спираль быстро опускают в подготовленную пробирку. Эту операцию повторяют несколько раз. Метанол превращается в формальдегид, имеющий резкий запах (нюхать осторожно!). б) Получение уксусного альдегида окислением этанола дихроматом калия. В пробирку насыпают 0,5 г дихромата калия, приливают 2 мл 10-% р-ра серной кислоты и постепенно при встряхивании – 2 мл этилового спирта. Пробирку закрывают пробкой с газоотводной изогнутой трубкой, конец которой опущен в пробирку-приемник с 2 мл воды. Приемник находится в стакане с ледяной водой. Осторожно нагревают пробирку с реакционной смесью и отгоняют летучие продукты в течение 2 - 3 мин. Часть полученного водного раствора, содержащего уксусный альдегид, используют для реакции с фуксинсернистой кислотой (появляется фиолетовая окраска), вторую – для реакции серебряного зеркала (опыт № 2 а), третью – для реакции с гидроксидом меди (II). в) Получение глицеринового альдегида окислением глицерина дихроматом калия. В пробирку наливают 1 мл 10 - % р-ра дихромата калия, 1 мл 10 - % р-ра серной кислоты и 1 мл глицерина. Смесь встряхивают, пробирку закрывают пробкой с изогнутой газоотводной трубкой и осторожно нагревают. Пары образующегося глицеринового альдегид пропускают в 1 мл р-ра фуксинсернистой кислоты, налитого в пробирку-приемник; появляется красно-фиолетовое окрашивание. г) Получение акролеина (Тяга!). Акролеин CH2 = CH – CHO получают из глицерина путем его дегидротации. Для этого в сухую пробирку насыпают слоем в 1 см KHSO4 и смачивают его 2 каплями глицерина. Смесь сильно нагревают до образования тяжелых паров акролеина с едким запахом (нюхать осторожно!). Гидросульфат калия при сильном нагревании превращается в пиросульфат калия K2S2O7, который отнимает воду. Когда из пробирки начнут выделяться тяжелые пары с резким запахом акролеина, ее закрывают пробкой с изогнутой газоотводной трубкой. Конец трубки опускают в другую пробирку с 2 мл воды, опущенную в стакан с ледяной водой. Нагревают 2-3 мин. до прекращения образования белых паров. Раствор акролеина делят на 4 части и проделывают с ним реакции на обнаружение альдегидной группы и двойной связи (реакции с Br2, р-ром KMnO4 и с Cu(OH)2). Рисунок или схема опыта: Наблюдения и уравнения реакций: Выводы: Опыт №2. Реакции окисления оксосоединений. а) Окисление аммиачным раствором оксида серебра. В четыре пробирки помещают по 5 капель оксосоединений : в 1-ую - формальдегид (из опыта № 1а ), во 2-ую - ацетальдегид ( из опыта № 1б), в 3-ю - акролеин ( из опыта № 1г), в 4-ую - ацетон. Добавляют в каждую пробирку аммиачного раствора оксида серебра. Смесь нагревают (осторожно!) несколько минут. Сравните изменения, происходящие в каждой пробирке. б) Окисление гидроксидом меди (11). В четыре пробирки помещают по 5 капель оксосоединений (опыт №2а ) и добавляют 2 мл 10-% р-ра гидроксида натрия и при встряхивании добавляют по каплям 2-% р-р сульфата меди (11) до появления неисчезающей взвеси. Верхнюю часть жидкости нагревают до начинающегося кипения. Эта реакция является качественной на альдегиды – реакция “хамелеон”, так как голубая окраска меняется на желтую, а затем на красную. Какие соединения меди имеют голубую, желтую и красную окраску? Почему при нагревании смеси гидроксида меди (11) с ацетоном образуется осадок черного цвета? Рисунок или схема опыта : Наблюдения и уравнения реакций : Выводы : Опыт № 3. Реакция ацетона с гидросульфитом натрия. В пробирку наливают 3 мл насыщенного раствора NaHSO3 и при энергичном встряхивании добавляют 1 мл ацетона. Смесь разогревается. При охлаждении ее в стакане с ледяной водой выпадает кристаллический осадок. Если осадок сразу не появится, то вызывают крсталлизацию потиранием стеклянной палочкой о стенки пробирки. Переносят немного кристаллов гидросульфитного соединения ацетона на предметное стекло и рассматривают их форму под микроскопом при увеличении в 120 раз. Напишите соответствующее уравнение реакции и рассмотрите ее механизм (AN). Рисунок или схема опыта : Наблюдения и уравнения реакций : Выводы : Опыт № 4. Получение фенолформальдегидной смолы. В большую пробирку с 1 г фенола (приготовленную лаборантом) прилейте 2 мл формалина и 3 капли р-ра аммиака. Смесь осторожно нагреть до появления взвеси (признак образования смолы). Охладить пробирку. Обратите внимание на расслоение жидкостей. Воду слейте, а оставшуюся темную жидкость нагрейте до образования густой вспенивающейся желтой массы, которую быстро вылейте на металлическую крышку. Опишите физические свойства полученной смолы. Запишите уравнение реакции получения фенолформальдегидной смолы. Каков тип этой реакции? Рисунок или схема опыта : Наблюдения и уравнения реакций : Выводы : Общий вывод по лабораторной работе: Самостоятельная работа по вариантам: Задание № 1: осуществите превращения с помощью химических уравнений реакций, укажите условия их протекания, дайте названия продуктам реакций. ( o ) C3H7OH 1-ый вариант: CaC2—› C2H2—› CH3COH—› C2H5OH—› CH3COH——›A———› B (O) (H) фенол 2-ой вариант: CH3COONa—› CH4—› CH3Br—› CH3OH—–› A—–› B——–› C Сu(OH)2  ———› А ———› АBr2 3  -ий вариант: 1,2,3-трихлорпропан—›пропантриол-1,2,3—›пропен-2-аль———› В -ий вариант: 1,2,3-трихлорпропан—›пропантриол-1,2,3—›пропен-2-аль———› ВHCI ———› С HBr KOH HOH (O) Br2 4-ый вариант: циклопропан —› А——› В—› пропен-1—–› С—› D—–›E CI2 Na O2, t HNO3 5-ый вариант: C3H8 —–› A —› B —› C6H6 —› C6H5CH3 ——› C6H5COH ——› C Решение : Задание № 2: решить расчетную задачу. В промышленности ацетальдегид получают по способу Кучерова. Какую массу ацетальдегида можно получить исходя из технического карбида кальция массой m кг, массовая доля примесей в котором составляет w-% ? Выход ацетальдегида ?-%.
Решение : Дополнительные задания: На “3”: При окислении некоторого карбонилсодержащего соединения массой 1,8 г аммиачным раствором оксида серебра получили серебро массой 5.4 г. Какое вещество подвергнуто окислению? На “4”: При взаимодействии этанола массой 13,8 г с оксидом меди (11) массой 28 г получили альдегид, масса которого составила 9,24 г. Определите выход продукта реакции. На “5”: Какая масса раствора с массовой долей уксусного альдегида 20 % образуется, если альдегид получили с выходом 75 % из ацетилена объемом 6,72 л (н. у.) по реакции Кучерова. Решение : Оценка за работу: |