Всероссийская олимпиада школьников
I (школьный) этап
Химия
10 класс 2011 г.
Общее время выполнения работы – 2,5 часа.
Задание 1.
Газ, образовавшийся при полном сгорании 3,6 г пирита, был пропущен через раствор, полученный в результате сливания 38,8 г 20%-ного раствора хромата калия и 61,2 г 6,4%-ного раствора серной кислоты. Рассчитайте массовые доли веществ в конечном растворе.
Количество баллов – 10.
Задание 2.
Смесь алкена с водородом общим объемом 26,88 л (н.у.) пропустили над платиновым катализатором при 200°С. При этом прореагировало 75% алкена, и объем смеси уменьшился до 20,16 л (н.у.). При пропускании исходной смеси через склянку с бромной водой весь углеводород прореагировал, и масса склянки увеличилась на 16,8 г.
Определите состав исходной смеси (в % по объему) и строение исходного алкена.
Количество баллов – 10.
Задание 3.
Напишите уравнения реакций, соответствующие схеме превращений:
t°, Pt KMnO4, H2O изб. HBr 2KOH(спирт.), t°
С2H5Cl → C3H8 ───→ X1 ─────→ X2 ─────→ X3 ─────────→X4
Количество баллов – 10.
Задание 4.
Какую массу соды можно получить из 10 л (н.у.) CO2 и 30 г NaOH? Сделайте отдельно расчеты для питьевой, кристаллической и кальцинированной соды, дайте этим веществам номенклатурные названия.
Количество баллов – 10.
Задание 5.
В четырех пробирках без надписей находятся водные растворы гидроксида натрия, соляной кислоты, поташа и сульфата алюминия. Предложите способ определения содержимого каждой пробирки, не применяя дополнительных реактивов.
Количество баллов – 10.
Всероссийская олимпиада школьников
I (школьный) этап
Химия
10 класс 2011 г.
Критерии проверки
Задание 1.
Газ, образовавшийся при полном сгорании 3,6 г пирита, был пропущен через раствор, полученный в результате сливания 38,8 г 20%-ного раствора хромата калия и 61,2г 6,4%-ного раствора серной кислоты. Рассчитайте массовые доли веществ в конечном растворе.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Сжигание пирита: 4FeS2 + 11O2= 2Fe2O3 + 8SO2↑
|
1
|
ν(FeS2)=3,6:120=0,03 (моль), следовательно ν(SO2)= 0,03∙2 = 0,06 (моль)
|
1
|
ν(K2CrO4) = (38,8∙0,2):194 = 0,04 (моль)
|
0,5
|
ν(H2SO4) = (61,2∙0,064):98 = 0,04 (моль)
|
0,5
|
При смешивании растворов хромата калия и серной кислоты образуется новый раствор массой 38,8 + 61,2 = 100 (г), который в результате реакции
2K2CrO4 + H2SO4 = K2Cr2O7 + К2SO4 + H2O (1)
содержит 0,02 моль K2Cr2O7, 0,02 моль К2SO4 и 0,02 моль H2SO4 (т.е. среда по-прежнему остается кислой за счет избытка серной кислоты)
|
1
1
1
|
При пропускании в этот раствор 0,06 моль SO2 происходит реакция:
K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + К2SO4 + H2O (2)
и конечный раствор содержит 0,02 моль Cr2(SO4)3 и 0,04 моль К2SO4 (из них 0,02 моль образовалось по реакции 1 и 0,02 моль по реакции 2).
|
1
1
|
Масса конечного раствора составляет 100 + 0,06∙64 = 103,84 (г)
|
1
|
ω(Cr2(SO4)3) = (0,02∙392):103,84 = 0,076 (7,6%)
|
0,5
|
ω(К2SO4) = (0,04∙174):103,84 = 0,067 (6,7%)
|
0,5
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 2.
Смесь алкена с водородом общим объемом 26,88 л (н.у.) пропустили над платиновым катализатором при 200°С. При этом прореагировало 75% алкена, и объем смеси уменьшился до 20,16 л (н.у.). При пропускании исходной смеси через склянку с бромной водой весь углеводород прореагировал, и масса склянки увеличилась на 16,8 г.
Определите состав исходной смеси (в % по объему) и строение исходного алкена.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
CnH2n + H2 = CnH2n+2
|
1
|
В реакцию вступает 2 моль газов (углеводород и водород), а образуется один моль (алкан). Таким образом, уменьшение объема смеси равно объему водорода, который вступил в реакцию, либо объему прореагировавшего алкена.
|
1
|
Этот объем составляет 26,88 - 20,16 = 6,72 (л), то есть 0,3 моль.
|
1
|
Так как прореагировало 75% алкена, то всего его было 0,4 моль.
|
1
|
При пропускании через бромную воду масса склянки увеличилась на массу углеводорода, т.е. 0,4 моль алкена имеют массу 16,8 г.
Молярная масса 16,8/0,4 = 42 (г/моль).
|
2
1
|
Алкен с такой молярной массой - C3H6 , пропен: Н3С-СН=СН2
|
1
|
Состав смеси: 0,4 моль пропена занимают объем 8,96 л.
Это составляет 33% (1/3) от объема смеси.
Остальное - 67% (2/3) - водород.
|
1
1
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 3.
Напишите уравнения реакций, соответствующие схеме превращений:
t°, Pt KMnO4, H2O изб. HBr 2KOH(спирт.), t°
С2H5Cl → C3H8 ───→ X1 ─────→ X2 ─────→ X3 ─────────→X4
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
1. С2H5Cl + СH3Cl + Mg → MgCl2 + CH3-CH2-CH3 (+ C4H10 +C2H6)
|
2
|
t°, Pt
2. CH3-CH2-CH3 ───→ H3C-CH=CH2 + H2
|
2
|
3. H3C-CH=CH2 + 2KMnO4 + 4H2O → 3H3C-CH(OH)-CH2OH +2MnO2+2KOH
|
2
|
4. H3C-CH(OH)-CH2OH + 2HBr → 2H2O + H3C-CH(Br)-CH2Br
|
2
|
t°
5. H3C-CH(Br)-CH2Br + 2 KOH(спирт.) → H3C-C≡CH + 2KBr +2H2O
|
2
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 4.
Какую массу соды можно получить из 10 л (н.у.) CO2 и 30 г NaOH? Сделайте отдельно расчеты для питьевой, кристаллической и кальцинированной соды, дайте этим веществам номенклатурные названия.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Количество реагентов:
углекислого газа 10: 22,4 = 0,466 (моль); щелочи 30 : 40 = 0,75 (моль).
|
1
|
Питьевую соду (гидрокарбонат натрия) можно получить так:
NaOH + CO2 = NaHCO3.
|
1
|
0,446 моль СО2, реагируют с 0,446 моль щелочи, т.е. CO2 у нас недостаток, ведем расчет по нему: m(NaHCO3) = 0,446∙Mr(NaHCO3) = 37,5 (г).
|
1
1
|
Кальцинированную соду (карбонат натрия) можно получить так:
2NaOH + CO2 = Na2CO3 + H2O.
|
1
|
0,75 моль щелочи реагируют с 0,375 моль CO2 , т.е. NaOH недостаток, следовательно: m(Na2CO3) = 0,375 ∙Mr(Na2CO3) = 39,75 (г).
|
1
1
|
Кристаллическая сода - это декагидрат карбоната натрия (Na2CO3∙ 10H2O).
|
1
|
Кристаллической соды можно получить столько же, сколько и кальцинированной соды, т.е. 0,375 моль.
Её масса составит 0,375∙Mr(Na2CO3∙ 10H2O) = 107,25 (г).
|
1
1
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 5.
В четырех пробирках без надписей находятся водные растворы гидроксида натрия, соляной кислоты, поташа и сульфата алюминия. Предложите способ определения содержимого каждой пробирки, не применяя дополнительных реактивов.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Составим таблицу возможных попарных взаимодействий веществ, в результате которых мы будем (или не будем) наблюдать определённые признаки реакций.
|
2
|
Вещества
|
1. NaOH
|
2 НСl
|
3. К2СО3
|
4. Аl2(SO4)3
|
Общий результат наблюдения
|
|
1, NaOH
|
X
|
—
|
—
|
Al(OH)3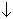
|
1 осадок
|
|
2. НС1
|
_
|
X
|
CO2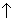
|
__
|
1 газ
|
|
3. К2СО3
|
—
|
CO2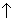
|
X
|
Al(OH)3 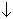
CO2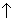
|
1 осадок и
2 газа
|
|
4. Al2(S04)3
|
А1(ОН)3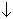
|
—
|
А1(ОН)3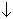
CO2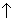
|
X
|
2 осадка и
1 газ
|
|
NaOH + HCl = NaCl + H2O
|
1
|
|
К2СO3 + 2HC1 = 2КС1 + Н2O + СO2
|
1
|
|
3K2CO3 + Al2(SO4)3 + 3H2O = 2Al(OH)3 + 3CO2 + 3CO2 + 3K2SO4; + 3K2SO4;
|
2
|
|
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4 + 3Na2SO4
Al(OH)3 + NaOH + 2H2O = Na[Al(OH)4(H2O)2]
( наличие осадка зависит от порядка сливания и избытка и щелочи)
|
1
1
|
|
Исходя из представленной таблицы по числу выпадения осадка и выделения газа можно определить все вещества.
|
2
|
|
Все элементы ответа записаны неверно
|
0
|
|
Максимальный балл
|
10
|
| |
 Скачать 83.14 Kb.
Скачать 83.14 Kb.