А. Задания с выбором ответа из предложенных
 Скачать 136.86 Kb. Скачать 136.86 Kb.
|
| А. Задания с выбором ответа из предложенных вариантов A1. Атом стронция имеет электронную формулу: 1) 1s22s22p63s23p64s2; 3) 1s22s22p63s23p63d104s24p65s2; 2) 1s22s22p63s23p63d104s2; 4) 1s22s22p63s23p63d104s24p64d105s2. А2. У атома таллия валентные электроны находятся на орбиталях: 1) 6s25p1; 2) 6s26p1; 3) 6s24f1; 4) 6s25f1. А3. Тип кристаллической решетки вещества определяется: 1) видом химической связи между частицами, находящимися в узлах кристаллической решетки; 2) частицами, находящимися в узлах кристаллической решетки; 3) физическими свойствами вещества; 4) расположением частиц в пространстве. А4. За счет только ковалентных полярных связей образованы молекулы веществ в ряду: 1) NaCl, N2, HCl; 2) O2,F2,H2; 3) KF, H2O, HCl; 4) HCl, CH4, H2O. А5. Степень окисления хрома в соединении Fe(CrO2)2: 1) 0; 2) +1; 3) +3; 4) +6. А6. Из приведенных ниже молекул газов наиболее прочной является: 1) H2; 2) F2; 3) N2; 4) O2. А7. Для оснований не характерно утверждение: 1) сложные вещества, в которых каждый атом металла связан с одной или несколькими гидроксигруппами; 2) взаимодействуют с кислотами; 3) взаимодействуют с кислотными оксидами; 4) взаимодействуют с основными оксидами. А8. Из опытов, иллюстрирующих химические свойства хлора, при обычных условиях можно осуществить: 1) горение сурьмы в хлоре; 3) взаимодействие хлора с натрием; 2) горение меди в хлоре; 4) взаимодействие хлора с железом. А9. С ростом порядкового номера элемента кислотные свойства оксидов в ряду N2О3–P2O3–As2O3–Sb2O3–Bi2O3: 1) усиливаются; 2) ослабевают; 3) остаются неизменными; 4) усиливаются, затем ослабевают. А10. В пробирку с нитратом цинка добавили немного гидроксида натрия. Образовался осадок. Его разделили на две части. В первую часть добавили раствор соляной кислоты, а во вторую – раствор гидроксида калия. При этом оказалось, что: 1) с осадком ничего не произошло; 2) в первой части осадок растворился, а во второй не растворился; 3) в первой части осадок не растворился, а во второй растворился; 4) в обеих частях осадок растворился. А11. Нельзя использовать для перевода гидроксида железа(III) в растворимое состояние раствор вещества: 1) NaOH; 2) HCl; 3) H2SO4; 4) CH3COOH. А12. Из газов: хлороводород, оксид углерода(IV), метан, аммиак – попарно несовместимы: 1) NH3 и HCl; 2) CO2 и CH4; 3) CO2 и HCl; 4) NH3 и CH4. А13. Наличие пентина-1 среди таких углеводородов, как пропен, бутан, гексадиен, можно определить реакцией с: 1) бромной водой; 3) водородом; 2) аммиачным раствором оксида серебра(I); 4) подкисленным раствором перманганата калия. А14. К дисахаридам относится ряд: 1) сахароза, мальтоза, лактоза; 3) крахмал, манноза, рибоза; 2) рибоза, глюкоза, фруктоза; 4) целлюлоза, сахароза, лактоза. А15. Толуол в лаборатории преимущественно получают: 1) фракционной перегонкой нефти; 3) дегидрированием метилциклогексана; 2) фракционной перегонкой каменноугольной смолы; 4) акилированием бензола. А16. Сложный эфир имеет следующую структурную формулу: CH3–CH2–CО–O–CH3. Название этого соединения: 1) метиловый эфир пропионовой кислоты; 3) метиловый эфир уксусной кислоты; 2) этиловый эфир уксусной кислоты; 4) этилпропионат. А17. Глюкоза обладает химическими свойствами, характерными для: 1) альдегидов и предельных углеводородов; 3) спиртов и карбоновых кислот; 2) непредельных углеводородов; 4) многоатомных спиртов и альдегидов. А18. Из перечисленных ниже веществ основные свойства наиболее выражены у: 1) аммиака; 2) этиламина; 3) диэтиламина ; 4) метиламина. А19. При действии на анилин хлороводорода получается вещество, относящееся к классу: 1) солей; 2) кислот; 3) жиров; 4) аминокислот. А20. Растворение одного моля безводной соды идет с выделением 25 кДж теплоты, а растворение одного моля кристаллогидрата с поглощением 67 кДж теплоты. Тепловой эффект реакции гидратации безводной соды равен (кДж): 1) +92; 2) –42 3) +42; 4) –92. А21. Считая, что реакция: 2А + Б идет в одну стадию, выражение для скорости реакции запишется: 1) А22. Равновесие системы, описываемое уравнением: N2 (г.) + 3H2 (г.) = 2NH3 (г.), при повышении давления сдвигается таким образом, что образуется: 1) больше NH3 (г.); 3) больше N2 (г.) и H2(г.); 2) больше H2 (г.); 4) никаких изменений в количествах реагентов и продуктов реакции не наблюдается А23. Постоянную жесткость воды нельзя устранить: 1) кипячением; 3) добавлением соды; 2) добавлением раствора фосфата калия; 4) пропусканием через катионообменную смолу. А24. Из реакций не может быть использована для получения карбоната кальция: 1) CaCl2 (р-р) + Na2CO3 (р-р) 2) CaCl2 (р-р) + CO2 А25. Приведенной схеме: M – ne 1) 2KOH + H2SO4 = K2SO4 + 2H2O; 3) Mg + 2HCl = MgCl2 + H2; 2) CaO + CO2 = CaCO3; 4) FeO + H2 = Fe + H2O. А26. Чтобы усилить гидролиз сульфида натрия, к его водному раствору необходимо добавить: 1) NaOH; 2) Ca(OH)2; 3) Na2SO4; 4) H2SO4. А27. При приливании раствора карбоната натрия к раствору хлорида алюминия(III): 1) выпадает белый осадок; 3) выпадает осадок и выделяется газ; 2) выделяется газ; 4) видимых изменений не происходит. А28. При окислении 0,25 моль сахарозы (н.у.) образуется следующий объем (л) оксида углерода(IV): 1) 0,13; 2) 7,5; 3) 36; 4) 67,2. А29. Получить 2-метилпентановую кислоту можно из спирта: 1) 2-метилпентанол-5; 2) 2-метилпентанол-1; 3) 3-метилпентанол-2; 4) 2-метилпентанол-3. А30. В двух склянках без этикеток находятся растворы глюкозы и фруктозы. Их можно достаточно надежно различить следующим образом: 1) визуально, сравнив цвет растворов; 2) по различию во взаимодействии продуктов их гидролиза с аммиачным раствором оксида серебра; 3) взвесив склянки с растворами; 4) по различию во взаимодействии растворов с аммиачным раствором оксида серебра. А31. Водород при обычных условиях не может образоваться в результате реакции: 1) Zn + HNO3 (разб.) 2) Zn + H2SO4 (разб.) А32. От примеси сероводорода очистить водород можно пропусканием последнего через раствор: 1) соляной кислоты; 2) серной кислоты; 3) нитрата свинца(II); 4) хлорида натрия. А33. Продуктом взаимодействия многоатомного спирта – глицерина – и азотной кислоты является нитроглицерин, который относится к классу: 1) нитросоединений; 2) сложных эфиров; 3) глицератов; 4) жиров. А34. При брожении глюкозы массой 180 г получена молочная кислота массой 153 г. Массовая доля выхода (в %) молочной кислоты составляет: 1) 42,5; 2) 52,3; 3) 85,0; 4) 95,0. А35. Для полного восстановления 9,5 кг оксида железа(III) необходим оксид углерода(II) объемом (м3): 1) 4; 2) 3; 3) 2; 4) 1. В. Задания с кратким ответом В1. В ядре иона Mn2+ содержится протонов ... . В2. Массовая доля (в %) сульфата натрия в растворе, полученном растворением 10 г его десятиводного кристаллогидрата в 100 г воды, равна ... . В3. В цепи превращений: этин вещество «Х» называется … (по систематической номенклатуре). В4. При электролизе водного раствора хлорида натрия на аноде выделилось три литра хлора (н.у.). За это же время на катоде выделился газ … объемом … (л). В5. При бромировании 112 мл (н.у.) предельного углеводорода образовалось 1,62 г бромоводорода. Число атомов водорода, замещенных в молекуле углеводорода бромом, равно … . В6. Предложенные ниже названия способов получения спиртов расположите в таблице в соответствии с уравнениями реакций: а) ферментативный синтез; в) синтез из галогенпроизводных углеводородов; б) получение из синтез-газа; г) гидратация этилена.
В7. В свободном виде этот моносахарид содержится почти во всех органах зеленых растений. Особенно его много в соке винограда, именно поэтому его иногда называют виноградным сахаром. Моносахарид, о котором идет речь, – это … . В8. Одну из аминокислот получают при взаимодействии аммиака с хлоруксусной кислотой. Как и все аминокислоты, она представляет собой белое кристаллическое вещество, растворимое в воде. Эта аминокислота называется … . В9. К водному раствору медного купороса прилили в избытке раствор щелочи. Выпавший осадок отфильтровали, промыли водой, высушили и прокалили. Полученный твердый остаток нагрели в атмосфере водорода. При этом получилось вещество, которое называется … . В10. При взаимодействии 10 г смеси железных и медных опилок с избытком соляной кислоты выделилось 2,24 л водорода (н.у.). Массовая доля (в %) меди в смеси составляет … . С. Задания с развернутым ответом С1. Как и во сколько раз изменится давление к моменту наступления равновесия реакции синтеза аммиака, протекающей в закрытом сосуде при постоянной температуре, если начальные концентрации азота и водорода в смеси равны соответственно 2 и 6 моль в литре смеси и равновесие наступит тогда, когда прореагирует 10% азота? С2. При сжигании 0,9 г газообразного вещества, масса 1 л которого при нормальных условиях равна 1,34 г, получено 672 мл углекислого газа (н.у.) и 0,54 г воды. Определите молекулярную формулу вещества. Какой примерно объем воздуха необходим для полного сгорания 1 м3 этого вещества? (Считать, что в воздухе примерно 20% кислорода по объему.) С3. Напишите уравнения реакций, соответствующих следующей cхеме: железо С4. Через 100 мл 32%-го раствора гидроксида калия ( С5. Напишите уравнения реакций, соответствующих приведенной ниже схеме: Назовите вещества А и Б (по систематической номенклатуре). Напишите уравнение реакции полимеризации вещества Б и назовите получившийся продукт. Ответы к варианту задания ЕГЭ по химииОтветы на задания с выбором ответа (задания группы А)
Ответы на задания с кратким ответом
Ответы на задания с развернутым ответом С1. Поскольку давление прямо пропорционально концентрации, то достаточно узнать число молей частиц в 1 л смеси до начала реакции и сопоставить их с числом молей частиц в момент равновесия. Уравнение реакции синтеза аммиака: N2 + 3H2 = 2NH3. Исходя из данных о начальной концентрации N2 и H2, находим общее число молей частиц до реакции: 2 + 6 = 8 моль. Затем по уравнению реакции находим число молей частиц в момент равновесия. В реакцию вступило 10% азота, что составляет: 2•0,1 = 0,2 моль. На это количество азота израсходовалось 0,6 моль водорода, и к моменту равновесия образовалось 0,4 моль аммиака. Равновесная концентрация азота: 2 – 0,2 = 1,8 моль; равновесная концентрация водорода: 6 – 0,6 = 5,4 моль. Общее число молей частиц в момент равновесия: 5,4 + 1,8 + 0,4 = 7,6 моль. В начальный момент общее число частиц было больше (8 моль). Значит, давления уменьшилось (8/7,6 = 1,05) в 1,05 раза. С2. Образование углекислого газа указывает на наличие в исходном веществе атомов углерода. По объему углекислого газа находим массу углерода, используя соотношения: m(C) = По массе воды находим массу водорода в исходном веществе: m(H) = 2(0,54/18)•1 = 0,06 г. Сумма масс углерода и водорода в исходном веществе равна: 0,36 + 0,06 = 0,42 г. При сопоставлении с массой исходного вещества делаем вывод о наличии в нем атомов кислорода. Масса кислорода в исходном веществе равна: 0,9 – 0,42 = 0,48 г. В общем виде формулу вещества можно представить так: СxHyOz. На основе закона постоянства состава и значений масс углерода, водорода и кислорода в веществе можно вывести простейшую формулу этого вещества. 12х : y : 16z = 0,36 : 0,06 : 0,48; х : y : z = 0,03 : 0,06 : 0,03. Заменив отношение дробных чисел на отношение целых чисел, получаем: х : y : z = 1 : 2 : 1, и простейшая формула вещества – СН2О. Из данных задачи находим молярную массу вещества: 22,4•1,34 = 30 г/моль. Сопоставив ее со значением относительной молекулярной массы вещества простейшей формулы (Mr(CH2O) = 30), приходим к выводу, что численно они совпадают. Значит, молекулярная формула вещества – СН2О. Уравнение реакции горения вещества: СН2О + О2 Из уравнения реакции видно, что на 1 м3 вещества требуется 1 м3 кислорода. Следовательно, воздуха потребуется в пять раз больше по объему, т.е. 5 м3. С3. Fe + 2HCl = FeCl2 +H2, FeCl2 + 2AgNO3 = 2AgCl Fe(NO3)2 + 2NaOH = Fe(OH)2 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3, 2Fe(OH)3 Fe2O3 + 3H2 С4. Уравнение реакции горения метана: Число молей СО2 равно: 18/22,4 = 0,8 моль. Число молей КОН равно: (100•1,32•0,32)/56 = 0,754 моль. В этих условиях реакция идет с образованием только кислой соли: Зная молярную массу соли: М(КНСО3) = 100 г/моль, находим массу соли: 0,754•100 = 75,4 г. C5. СН3СООNa + NaOH 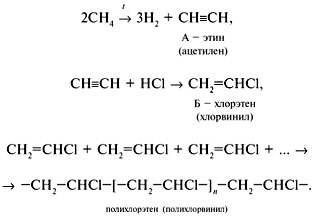 |