Пояснительная записка Для реализации Рабочей программы используется
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов 9. Этилен можно получить в результате реакций 1) разложения метана 2) гидрирования этана 3) дегидратации этанола 4) гидрирования ацетилена 5) углерода с водородом 10. Установите соответствие между структурной формулой углеводорода и общей формулой его гомологического ряда. ФОРМУЛА ОБЩАЯ УГЛЕВОДОРОДА ФОРМУЛА А) СН2 = СН- СН2 - СН(СНз) 1) СnН2n + 2 Б) СНз-С ≡ С-СН2-СН3 2) СnН2n - 2 В) С6Н5 - СН(СН3)2 3) СnН2n - 6 Г) СН2 = СН - С(СНз) = СН2 4) СnН2n При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат. 11 . Допишите уравнения реакций 1) С2H4 + HCl → 2) CH≡C-CH3 + H2O → 3) C6H6 + Br2 → 12. Какой объем метана (н.у.) выделится при взаимодействии карбида алюминия массой 28,8 г с водой? Контрольная работа № 2 по теме :«Углеводороды» ВАРИАНТ 2 При выполнении заданий № 1-8 выберете номер правильного ответа. 1. Общая формула гомологического ряда алкинов 1) СnН2n 2) СnН2n.2 3) СnН2n+2 4) СnН2n-6 2. Вещество, формула которого СН=СН2 │ СН2 - СН │ │ СН3 СН3, называется 1) З-метилпентен-1 2) 1,2-диметилбутен-4 3) 3,4-диметилбутен-1 4) 3 -метилбутен-1 3. Изомерами являются 1) циклогексан и 2-метилпентан 2) гексин-1 и гексадиен-2,4 3) пентен-2 и пентадиен-2,3 4) бутадиен-1,3 и циклобутан 4. Для строения молекулы бензола характерно(а) 1) sp3-гибридизация орбиталей атомов углерода 2) одинарная связь между атомами углерода 3) расположение всех σ-связей в одной плоскости 4) наличие между атомами водорода π-связей 5. Бутен-1 реагирует с 1) NаОН(р-р) 2) СuО 3) СO2 4) КМnО4(р-р) 6. Верны ли следующие суждения о химических свойствах этина? А. Для этина нехарактерны реакции присоединения. Б. Этин реагирует с натрием. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 7. Бензол реагирует с 1) HNO3 2) НВr(р-р) 3) КМnO4(р-р) 4) Н2О 8.В схеме превращений бутен-2 → X → 2-метилпропан веществом «X» является 1) бутан 2) пропан 3) 2-метилбутен-2 4) 2-метилбутан Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов. 9. Ацетилен можно получить в результате реакций 1) разложения бутана 2) гидрирования этена 3) разложения метана 4) гидролиза карбида кальция 5) дегидратацией этилового спирта 10. Установите соответствие между структурной формулой углеводорода и общей формулой его гомологического ряда. ФОРМУЛА УГЛЕВОДОРОДА А) СН3 - С(СН3)2 - С ≡СН Б) СН2 = С = СН-СН2-СН3 В) СН3 - СН2 - СН = СН2 Г) СН3-С6Н4-СНз ОБЩАЯ ФОРМУЛА 1) СnН2n + 2 2) СnН2n - 2 3) СnН2n - 6 4) СnН2n 11. Допишите уравнения реакций 1) СH≡C-CH3 + HCl → 2) СН2 = СН - СН = СН2 + Вr2 → 3) C6H5-CH3 + НNО3 → 12. Определите массу бензола, образовавшегося из ацетилена объемом 6,72 л (н.у.). (Выход продукта считать 100 %.) Контрольная работа № 3 по теме: «Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты» ВАРИАНТ 1 При выполнении заданий № 1-8 выберете номер правильного ответа. 1. К классу альдегидов относится 1) метаналь 2) этилацетат 3) фенол 4) этиленгликоль 2. Пропаналь имеет формулу 1) СН3 - СН2 - СН2ОН 2) СН3 - СН(ОН) - СН3 3) СН3 - СН2 - СНО 4) СН3-СН2-СООН 3. Функциональная группа -СООН присутствует в молекуле 1) муравьиной кислоты 2) этилацетата 3) фенола 4) этиленгликоля 4. Верны ли следующие суждения о свойствах спиртов? А. Между молекулами спиртов образуются водородные связи. Б. В реакции этанола с натрием выделяется водород. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 5. При бромировании фенола образуется 1) бромфенол и бромоводород 2) 2,4,6-трибромфенол и бромоводород 3) бензол и бромоводород 4) бромбензол и вода 6. При взаимодействии аммиачного раствора оксида серебра с пропионовым альдегидом образуются 1) серебро, углекислый газ и вода 2) серебро, пропановая кислота и вода 3) нитрат серебра и пропановая кислота 4) серебро и пропановая кислота 7. Муравьиная кислота вступает в реакцию с 1) Сu(ОН)2 2) С2Н4 3) Nа2SО4 4) КаС1 8. В процессе домашнего консервирования овощей применяют 1) метаналь 2) фенол 3) уксусную кислоту 4) ацетат натрия Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов. 9. Этанол в одну стадию можно получить из 1) этилена 2) уксусной кислоты 3) этана 4) этиленгликоля 5) хлорэтана 6) этилацетата Ответ: ________ 10. Метанол и метаналь можно распознать с помощью веществ 1) О2 2) Nа 3) [Аg(NН3)2]ОН 4) Сu(ОН)2 5) КОН 6) NaHCO3 Ответ: ____________ При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат. 11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их проведения. этилен → этанол→ этаналь →уксусная кислота 12. Какая масса пропанола потребовалась для получения 0,2 моль пропена в результате дегидратации? Контрольная работа № 3 «Спирты и фенолы. Альдегиды и кетоны. Карбоновые кислоты» ВАРИАНТ 2 При выполнении заданий № 1-8 выберете номер правильного ответа. 1. К классу одноатомных спиртов относится 1) метаналь 2) этилацетат 3) пропанол 4) этиленгликоль 2. Вещество, структурная формула которого СНз - СН2 - СООН, называется 1) пропаналь 2) пропанол-1 3) пропановая кислота 4) глицерин 3. Функциональная группа -ОН присутствует в молекуле 1) бензола 2) фенола 3) этилацетата 4) этилена 4. Верны ли следующие суждения о свойствах спиртов? А. Молекулы спиртов содержат гидроксильные группы. Б. В реакции этанола с уксусной кислотой образуется жир. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 5. Продуктами реакции фенола с натрием являются 1) фенолят натрия и вода 2) фенолят натрия и водород 3) бензол и гидроксид натрия 4) бензоат натрия и водород 6. Уксусный альдегид взаимодействует с каждым из двух веществ 1) Н2О и С2Н6 2) N2 и Аg2О 3) Сu(ОН)2 и Н2 4) С6Н6 и Н2O 7. С уксусной кислотой взаимодействует 1) хлорид калия 2) медь 3) нитрат цинка 4) оксид магния 8. В качестве дезинфицирующего средства можно использовать 1) фенол 2) глицерин 3) муравьиную кислоту 4) бензол Ответами к заданиям № 9-10 является последовательность цифр, которая соответствует номерам правильных ответов. 9. Альдегид в одну стадию можно получить из 1) хлорэтана 2) этана 3) этанола 4) этиленгликоля 5) ацетилена 6) пропанола-1 10. Для распознавания растворов этиленгликоля и муравьиной кислоты можно использовать реактивы 1) NаВr 2) Н2 3) [Аg(NН3)2]ОН 4) фенолфталеин 5) Сu(ОН)2 6) Na2CO3 При выполнении заданий № 11-12 подробно запишите ход их решения и полученный результат. 11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения, укажите условия их проведения. ацетилен → этаналь→ этанол → хлорэтан 12. Какая масса этаналя была окислена аммиачным раствором оксида серебра, если в результате выделилось 0,3 моль серебра? Контрольная работа №4 по теме: «Кислородсодержащие органические соединения. Азотсодержащие органические соединения» Вариант 1. 1. Межклассовыми изомерами являются: 1) альдегиды и карбоновые кислоты; 2) одноатомные спирты и фенолы; 3) простые эфиры и одноатомные спирты; 4) карбоновые кислоты и двухатомные спирты 2. Общая формула альдегидов: 1) Cn H2n O2 3) Cn H2n O 2) Cn H2n+1 O2 4) Cn H2n+1 OH 3.Продуктами восстановления альдегидов водородом (катализатор Pt) являются: 1) кетоны 2) сложные эфиры 3) простые эфиры 4) одноатомные спирты 4. Этанол не вступает в реакцию с веществом, формула которого: 1) Na 2) HBr 3) NaOH 4) CH3COOH 5. Формула CH3– CH2 – CH2 – CH2 - OH , а вещество называется: 1) 2-метилпропанол-2 2) бутанол-1 3) 2-метилпропанол-1 4) пропанол-1 6. Аминоуксусная кислота реагирует 1)натрием 2)медью 3) хлоридом натрия 4) серой 7. Гомологом для вещества CH3 - CH2 – OH является: 1) уксусная кислота 2) этаналь 3) пропанол-1 4) диметиловые эфиры 8. Белки распознаются при помощи
9. Установить соответствие между структурной формулой вещества и названием гомологического ряда к которому оно принадлежит: Структурная формула вещества Названием гомологического ряда 1  ) CH3 - CH – CHO А) Предельные амины ) CH3 - CH – CHO А) Предельные аминыCH3 Б) Сложные эфиры 2) CH3 – CH2 - O – CH2 – CH3 В) Простые эфиры 3) CH3 - COO – CH3 Г) Предельные одноатомные спирты 4) CH3 - CH(OH) – CH(OH) – CH3 Д) Многоатомные спирты 5) СН3 – NН2 Е) Альдегиды 10. Для предельных одноатомных спиртов характерны реакции: 1) Этерификации 4) Окисления 2) Дегидратации 5) Полимеризации 3) Гидратации 6) Нейтрализации 11. Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения: CН3СООН → CH3COO C2Н5 → C2 Н5OH → СО2 12. При восстановлении 500 г нитробензола получили 300 г анилина. Вычислите выход продукта реакции от теоретически возможного. Контрольная работа №4 по теме: «Кислородсодержащие органические соединения. Азотсодержащие органические соединения» Вариант 2. 1. Общая формула СnH2nO2 соответствует: 1) альдегидам 2) фенолам 3) предельным одноатомным спиртам 4) карбоновым кислотам 2. Фенол реагирует с 1) Br2 2) Na2CO3 3) NaCl 4) Cu(OH)2 3. Этанол можно получить из этилена в результате реакции 1) гидратации 3) галогенирования 2) гидрирования 4) гидрогалогенирования 4. При щёлочном гидролизе 2-хлорбутана преимущественно образуется 1) бутанол-2 3) бутаналь 2) бутанол-1 5. При кислотном гидролизе этилацетата образуются 1) этанол и муравьиная кислота 3) метанол и муравьиная кислота 2) этанол и уксусная кислота 4) метанол и уксусная кислота 6. Ацетальдегид не реагирует с 1) аммиачным раствором оксида серебра 3) водородом 2) гидроксидом меди(II) 4) гидроксидом натрия 7. Уксусная кислота реагирует с 1) хлором 3) медью 2) водородом 4) хлоридом натрия 8. Анилин можно получить 1)дегидратацией спиртов 3) восстановлением нитробензола 2)дегидрированием альдегидов 4) гидрированием алкенов 9. Аминоуксусная кислота может вступать в реакции с 1) водородом 4) хлоридом хрома (III) 2) бромоводородом 3) натрием 5) азотом 6) карбонатом натрия 10.Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит. Название вещества Класс органических соединений А) глицерин 1) альдегиды Б) анилин 2) простые эфиры В) бутанол -1 3) ароматический амин Г) пропаналь 4) многоатомный спирт 5) одноатомный спирт 6) карбоновая кислота 11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: C6Н6 → С6Н5 Cl → С6Н5ОН → C6 Н2 Br3OH 12. Сколько г анилина можно получить из 125 г нитробензола, если выход анилина составляет 65% по сравнению с теоретическим. Инструкционные карты к практическим работам Практическая работа №1 Качественное определение углерода, водорода, хлора в органических веществах Цель работы: экспериментальным путем доказать наличие атомов углерода, водорода и хлора в органических соединениях. Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, нагревательный прибор, спички. Вещества: парафин, оксид меди (II), сульфат меди (II), медная проволока, дихлорметан Техника безопасности: Опасайтесь растрескивания стеклянной посуды при нагревании. Соблюдайте правила нагревания. Будьте осторожны в обращении с растворами солей. Собирайте остатки веществ в специально предназначенную посуду. Запрещается оставлять неубранными рассыпанные реагенты. Ход работы 1. В сухую пробирку поместите около 1 г порошка оксида меди(II) и 0,2 г парафина. Пробирку нагрейте до плавления парафина и затем содержимое ее встряхните, чтобы вещества хорошо перемешались. Пробирку закрепите в штативе в горизонтальном положении (рис.) и поместите в нее недалеко от открытого конца немного безводного сульфата меди (II). Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку с известковой водой. Содержимое пробирки слегка нагрейте и наблюдайте за происходящими изменениями. Задания для самостоятельных выводов. 1. Почему изменяется цвет сульфата меди(II)? О содержании какого элемента в исследуемом веществе это свидетельствует? 2. О содержании какого элемента свидетельствует помутнение известковой воды? 3. Что образовалось из оксида меди(II) и какие наблюдения это подтверждают? Напишите уравнения всех реакций, которые происходят при этом. Для парафина используйте его усредненную формулу С23Н48. 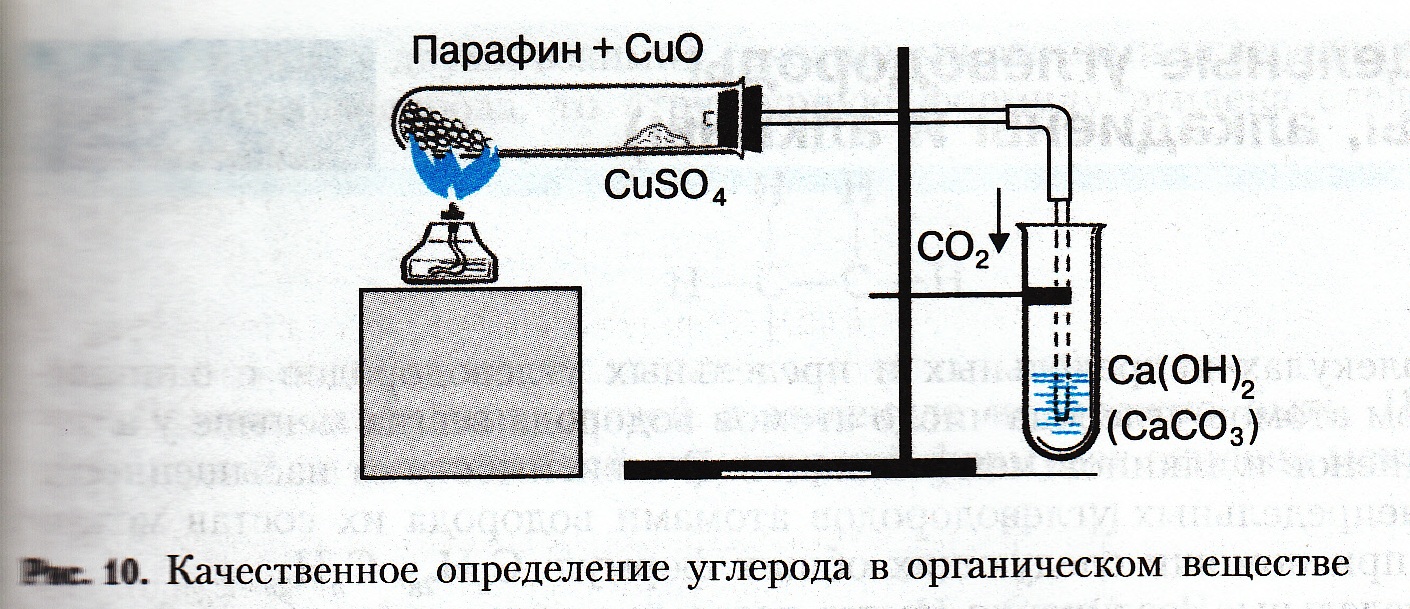 2. Возьмите спираль из медной проволочки и прокаливайте ее в пламени до тех пор, пока пламя перестанет окрашиваться в зеленый цвет. Прокаленную спираль опустите в пробирку с дихлорметаном, затем вновь поместите спираль в пламя горелки. Наблюдайте зеленое окрашивание пламени, свидетельствующее о наличии хлора в органическом растворителе. При взаимодействии меди с хлором образуется хлорид меди(II), который и дает пламени зеленое окрашивание. Задание для самостоятельного вывода. От присутствия какого элемента пламя окрашивается в зеленый цвет? Практическая работа № 2 «Получение этилена и изучение его свойств» Цель работы: экспериментальным путём получить этилена и изучить его свойства Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички. Реагенты: в пробирке №1 готовая смесь концентрированной серной кислоты и этилового спирта с несколькими крупинками песка; в пробирке №2 раствор перманганата калия. Техника безопасности:
Xoд работы 1. В одну пробирку налейте 2—3 мл этилового спирта и осторожно добавьте 6—9 мл концентрированной серной кислоты. Затем всыпьте немного предварительно прокаленного песка, чтобы избежать толчков жидкости при кипении. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте. 2. В другую пробирку налейте 2—3 мл бромной воды. Опустите газоотводную трубку до дна пробирки с бромной водой и пропустите через нее выделяющийся газ. 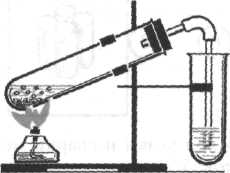
Задания для самостоятельных выводов. 1. Какой газ выделяется при нагревании смеси этилового спирта с серной кислотой? Что происходит при пропускании этого газа через бромную воду и раствор перманганата калия? Почему этилен горит более светящимся пламенем, чем метан? Напишите уравнения соответствующих реакций. 2. Чем отличаются свойства этилена от свойств предельных углеводородов? 5.Заполните таблицу:
6.После окончания работы приведите в порядок своё рабочее место Практическая работа № 3 «Получение и свойства карбоновых кислот» Цель работы: повторить, систематизировать, практически подтвердить физические и химические свойства карбоновых кислот, научиться их получать на примере уксусной кислоты. Оборудование: химический штатив, лапка, муфта, пробка с газоотводной трубкой, горелка, спички, пробирки. Вещества: ацетат натрия, концентрированная серная кислота, раствор уксусной кислоты, стружки магния, гранулы цинка, , раствор фенолфталеина, раствор гидроксида натрия, раствор изоамилового спирта, раствор нитрата серебра, раствор аммиака, раствор муравьиной кислоты Техника безопасности: Опасайтесь растрескивания стеклянной посуды при нагревании. Соблюдайте правила нагревания. Будьте осторожны в обращении с растворами кислот, щелочей. Собирайте остатки веществ в специально предназначенную посуду. Запрещается оставлять неубранными рассыпанные реагенты. Ход работы 1. Получение уксусной кислоты. Поместите в пробирку 2—3 г ацетата натрия и прибавьте 1,5—2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис.). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0—1,5 мл жидкости. Задания для самостоятельных выводов. 1, Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции. 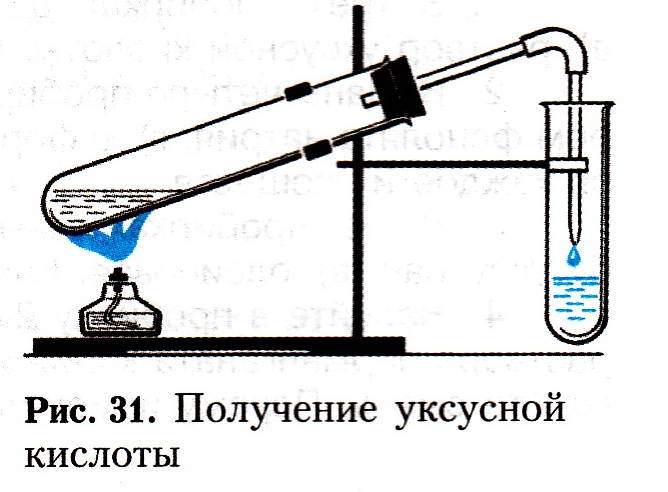 2. Взаимодействие уксусной кислоты с некоторыми металлами. В две пробирки налейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а в другую — несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании). Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде. 3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 — 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает. 4. Взаимодействие уксусной кислоты со спиртами. В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане. После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции. Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции. 5. Окисление муравьиной кислоты оксидом серебра(I). В чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата серебра(I) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой. Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции. Практическая работа № 4 «Решение экспериментальных задач по распознаванию органических веществ» Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности. Оборудование : горелка, спички, пробиркодержатель, пробирки Вещества: пробирки с гексаном, бензолом, раствором уксусной кислоты, пробирки с глицерином, этанолом, формалином, пробирки с растворами муравьионой, уксусной, олеиновой кислот Техника безопасности : Соблюдайте осторожность в работе с растворами кислот, солей, щелочей. Соблюдайте правила нагревания. Опасайтесь растекания посуды. Помните о правилах ознакомления с запахом. Запрещается оставлять не убранными разлитые и рассыпанные реагенты. Ход работы Решение экспериментальных задач на распознавание органических веществ 1. В трех пробирках даны следующие вещества: а) гексан; б) бензол; в) раствор уксусной кислоты. Определите каждое из веществ. 2. Выданы четыре пробирки: а) с глицерином; б) с этанолом; в) с раствором фенолята натрия; г) с формалином. Определите, в какой пробирке находится каждое из веществ. 3. В трех пробирках даны следующие карбоновые кислоты: а) муравьиная; б) уксусная; в) олеиновая. Как различить эти вещества? 4. Налейте в пробирку 2 мл этанола, прилейте к нему 2 мл разбавленного раствора перманганата калия и добавьте несколько капель серной кислоты. Нагрейте смесь. Почему изменилась окраска раствора? Практическая работа №5 «Решение экспериментальных задач на получение и распознавание органических веществ» Цель: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств изученных классов органических соединений , умения их распознавать и навыки основ лабораторного эксперимента и техники безопасности. Оборудование: горелка, спички, пробиркодержатель, пробирки Вещества: пробирки с этанолом, глицерином, раствор сульфата меди (II), раствор гидроксида натрия, стружки магния, пробирки с раствором фенола и раствором метаналя, йодная вода, аммиачный раствор оксида серебра, этиловый спирт, медная проволока, раствор уксусной кислоты, концентрированная серная кислота, карофель, белый хлеб, яблоко, раствор йода. Техника безопасности : Соблюдайте осторожность в работе с растворами кислот, солей, щелочей. Соблюдайте правила нагревания. Опасайтесь растекания посуды. Помните о правилах ознакомления с запахом. Запрещается оставлять не убранными разлитые и рассыпанные реагенты. Ход работы 1. В двух пробирках даны вещества: а) этанол; б) глицерин. Проделайте опыты, подтверждающие их характерные свойства. Составьте уравнения соответствующих реакций. 2. В одной пробирке дан раствор фенола, а в другой — раствор метаналя. Проделайте опыты, которые подтверждают их характерные химические свойства. Напишите уравнения соответствующих реакций. 3. В двух пробирках даны вещества: а) глюкоза; б) сахароза. Определите эти вещества при помощи характерных химических реакций и приведите соответствующие уравнения реакций. 4. Из этилового спирта получите: а) простой эфир; б) альдегид; в) кислоту; г) сложный эфир. Составьте уравнения соответствующих реакций. 5. Докажите на опыте, что обычный сахар содержит углерод. 6. Докажите опытным путем, что: а) картофель и белый хлеб содержат крахмал; б) спелое яблоко содержит глюкозу. 7. Определите с помощью характерных реакций каждое из трех предложенных веществ: а) крахмал, сахар, глюкозу; б) глицерин, мыло, крахмал (растворы). Практическая работа № 6 Распознавание пластмасс и волокон Цель работы: На основе знания состава и строения полимеров уметь распознавать в лабораторных условиях наиболее употребляемые пластмассы и волокна. Оборудование: железная ложка для сжигания, горелка, спички, стеклянная палочка, три пронумерованные пробирки с образцами пластмасс, три пронумерованные пробирки с образцами волокон. Реагенты: концентрированная серная кислота (на демонстрационном столе), универсальная индикаторная бумага, раствор гидроксида натрия, универсальная бумага, вода в пробирке для смачивания индикаторной бумаги. Техника безопасности: Соблюдайте правила работы с горелками. Будьте осторожны в обращении с растворами кислот. Запрещается оставлять неубранными рассыпанные реагенты. Ход работы:
2.В трех пробирках находятся пластмассы: полистирол, полиэтилен, капрон. Определите, в какой из пробирок находится каждое вещество. В трех пробирках находятся волокна: хлопок, натуральный шелк, вискоза. Определите, какое волокно находится в каждой пробирке.
Распознавание пластмасс
Распознавание волокон
После окончания работы приведите в порядок своё рабочее место 11 класс
Контрольная работа №1 по теме: « Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества». Вариант 1. А1. Сумма протонов, нейтронов и электронов в атоме 40Са равна 1) 40 2) 60 3) 30 4) 50 А2. Какую электронную конфигурацию имеет атом наиболее активного металла? …..3s23p1 2) …..3s2 3) …..3s1 4)…..3s23p2 А3. Элементы расположены в порядке уменьшения их атомов радиуса: 1) F-Br-H-CI 2) H-F-CI-Br 3). Br-CI-F-H 4). H-CI-Br-F А4. Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
А5. Изотопы одного и того же элемента отличаются друг от друга
В1. Установите соответствие между веществом и видом связи атомов в этом веществе. НАЗВАНИЕ ВЕЩЕСТВА ВИД СВЯЗИ
В) аммиак 3) ковалентная полярная Г) хлорид кальция 4) ковалентная неполярная
В2. Установите соответствие между химической формулой соединения и значением степени окисления серы в нем. ФОРМУЛА СОЕДИНЕНИЯ СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ A)Mg(HS04)2 1)0 Б) А12S3 2)+2 B)S8 3)+4 Г)(NH4)2SO3 4)+6 5)-2 С1. Вычислите массу соли и объём газа, который выделится при взаимодействии цинка с 150 г 20% соляной кислотой. Контрольная работа №1 по теме: « Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение вещества» Вариант 2. А1. Иону S2- соответствует электронная формула 1)ls22s22p63s23p6 2) ls22s22p63s23p4 3) ls22s22p6 4) ls22s22p63s23p2 А2. Число нейтронов в ядре атома 39К равно
А3. Химический элемент расположен в четвертом периоде, в IA группе. Распределению электронов в атоме этого элемен- та соответствует ряд чисел 1)2,8,8,2 3)2,8,8,1 2)2,8,18,1 4)2,8,18,2 А4. В ряду химических элементов Na - Mg - Al – Si
А5. Вещества, имеющие молекулярную кристаллическую решётку, как правило: 1) тугоплавки и хорошо растворимы в воде 2)легкоплавки и летучи 3) твёрды и электропроводны 4)теплопроводны и пластичны В1. Установите соответствие между формулой частицы и её электронной конфигурацией Частица электронная конфигурация А) S0 1) 1s22s22p63s2 Б) Cl+7 2) 1s22s22p63s23p4 В) Р+3 3) 1s22s22p5 Г) N-2 4) 1s22s22p6 В2. Установите соответствие между веществами и типом химической связи в них
С1. Рассчитайте массовую долю соли в растворе, полученном при растворении 1,3 г цинка в 36,5 г 10 % раствора соляной кислоты. Контрольная работа №2 по теме «Химические реакции» Вариант1. А1. Реакция, уравнение которой CaCO3 (к) = CaO (к) + CO2 (г) – Q, относится к реакциям 1) соединения, экзотермическая 2) разложения, эндотермическая 3) соединения, эндотермическая 4) разложения, экзотермическая А2 . Сокращенное ионное уравнение реакции Al3+ + 3OH– = Al(OH)3 соответствует взаимодействию 1) хлорида алюминия с водой 2) алюминия с водой 3) хлорида алюминия со щелочью 4) алюминия со щелочью А3. Какой из факторов не оказывает влияния на скорость химической реакции в растворах? 1) концентрация веществ 2) использование катализатора 3) использования ингибитора 4) объём реакционного сосуда А4. Химическое равновесие в системе 2NO(г) + O2 (г) ↔ 2NO2 (г) + Q смещается в сторону образования продукта реакции при
А5. К реакциям гидролиза относится взаимодействие с водой 1) натрия 2) оксида натрия 3) хлорида натрия 4) карбоната натрия В1. Установите соответствие между названием соли и реакцией среды ее водного раствора.
В2. В соответствии с термохимическим уравнением реакции С(тв) + О2(г) = СО2(г) + 393,3 кДж при выделении 1180,9 кДж теплоты масса сгоревшего углерода равна ______г. (Запишите число с точностью до целых) С1. Используя метод электронного баланса, составьте уравнение реакции: КМnO4 → К2МnO4 + ...+ ... . Определите окислитель и восстановитель. С2. Вычислите объём углекислого газа, который образуется при разложении 300 г карбоната кальция, содержащего 10 % примесей. Контрольная работа №2 по теме «Химические реакции» Вариант2. А1. Реакция горения аммиака 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) + Q является реакцией 1) соединения, каталитической, эндотермической 2) замещения, каталитической, экзотермической 3) окислительно-восстановительной, некаталитической, экзотермической 4) обмена, некаталитической, эндотермической А2. Увеличение давления повысит скорость химической реакции между 1) Fe и H2SO4 (р-р) 2) NH3 и O2 3) Zn и HCl (p-p) 4) BaCl2 (p-p) и H2SO4 (p-p) А3. Сильными электролитами являются: 1) HCl и AgNO3 2) Fe(OH)3 и H2SO4 3) Zn(OH)2 и H2S 4) H3PO4 и Ag3PO4 А4. Химическое равновесие в системе CO2 (г) + C (тв) ↔ 2CO (г) – Q сместится вправо при 1) повышении давления 2) понижении температуры 3) повышении концентрации СО 4) повышении температуры А5. В качестве анионов только гидроксид-ионы образуются при диссоциации 1) Ba(OH)2 2) CH3 – OH 3) (CuOH)2CO3 4) HCOOH В1. Установите соответствие между реагентами и ионно-молекулярным уравнением реакции. РЕАГЕНТЫ ИОННО-МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ А) NaOH + HNO3 1) CaCO3 + 2H+ = Ca2+ + H2O + CO2 Б) Na2CO3 + HCl 2) CO32– + H2O = HCO3– + OH– В) Na2CO3 + CO2 + H2O 3) OH– + H + = H2O Г) CaCO3 + HCl 4) CO32– + 2H+ = CO2 + H2O 5) CO32– + CO2 + H2O = 2HCO3– В2. При образовании аммиака согласно уравнению реакции: N2 ( г) + 3H2 (г) = 2NH3 (г) + 92 кДж, выделилось 23 кДж теплоты. При этом объём (н.у.) составил: ___.(Ответ округлите до целых) С1. Используя метод электронного баланса, составьте уравнение реакции: К2МnO4+НСl →МnС12 + С12 +...+ ... . Определите окислитель и восстановитель. С2. Вычислите объём углекислого газа, который образуется при разложении 600 г карбоната кальция, содержащего 20 % примесей. Контрольная работа №3 по теме: « Металлы» Вариант1. А1. Электронной конфигурации иона Mg+2 соответствует формула 1) 1s22s22p63s23p63d104s2 2) 1s22s22p63s23p1 3) 1s22s22p63s2c 4) 1s22s22p6 А2. Одинаковую степень окисления хром проявляет в соединениях: 1) СrCl3 и CrO3 2) K2CrO4 и K2Cr2O7 3) K2Cr2O7 и Cr2S3 4) KCrO2 и K2CrO4 А3. Верны ли следующие суждения о промышленных способах получения металлов? А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах. Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны А4. Oснόвные свойства ослабевают в ряду веществ: 1) Li2O K2O Rb2O 2) Al2O3 MgO Na2O 3) CaO MgO BeO 4) B2O3 BeO Li2O А5. Медь реагирует с каждым из двух веществ: 1) AgNO3 и O2 2) NaOH и HCl 3) Cl2 и H2O 4) HNO3 и MgCl2 А6. Гидроксид магния можно получить реакцией ионного обмена при взаимодействии 1) хлорида магния с гидроксидом калия 3) оксида магния с гидроксидом калия 2) оксида магния с водой 4) карбоната магния с гидроксидом калия В1.Установите соответствие между веществами, вступившими в реакцию и продуктами реакции ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ 1) Fe + Cl2 → а) FeCl2 2) Cr(OH)3 + NaOH → б) Na2[Cr(ОН)6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||