Пояснительная записка Для реализации Рабочей программы используется
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
Практическая работа №5 Решение экспериментальных задач по теме «Металлы и неметаллы» Цель работы: выбором оптимального варианта решения экспериментальных задач проверить знания характерных свойств металлов и неметаллов и их соединений и способов их получения. Оборудование: пробирки, горелка (спиртовка), держатель для пробирок, спички. Реактивы: Техника безопасности: - Будьте осторожны с растворами щелочей, кислот, солей - Опасайтесь растрескивания пробирки при её нагревании - Соблюдайте правила работы со спиртовкой (горелкой) - Помните о правилах ознакомления с запахом - Работу проводить только над лотком -Запрещается оставлять неубранными разлитые и рассыпанные реагенты. Ход работы 3. Описание и результаты опытов занесите в таблицу:
4. Приведите своё рабочее место в порядок ИНСТРУКЦИОННАЯ КАРТА Практическая работа № 6 «Получение, собирание, распознавание газов и изучение их свойств» Вариант 1 Цель: основываясь на знаниях, полученных в 8-9 классе повторить технику получения кислорода и аммиака, вспомнить свойства полученных веществ. Оборудование: штатив большой лабораторный, муфта, лапка, пробирки, пробка с газоотводной трубкой, лучинка, горелка (спиртовка), спички. Реагенты: перманганат калия, концентрированная соляная кислота, хлорид аммония, гидроксида натрия, лакмусовая бумажка. Техника безопасности: - Будьте осторожны с растворами щелочей, кислот, солей - Опасайтесь растрескивания пробирки при её нагревании - Соблюдайте правила работы со спиртовкой (горелкой) - Помните о правилах ознакомления с запахом - Работу проводить только над лотком -Запрещается оставлять неубранными разлитые и рассыпанные реагенты. Ход работы 1.Запишите в тетради тему практического занятия и вариант. 2. Опыт №1 Получение кислорода: - Соберите прибор для получения кислорода
3. Опыт №2.Получение аммиака 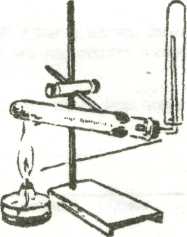 -Соберите прибор как показано на рис. - В сухую пробирку поместите смесь хлорида аммония и гидроксида кальция. Закройте пробкой с газоотводной трубкой, укрепите в лапке штатива. -Прогрейте сначала всю (2-3 движения пламени), а затем нагрейте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную лакмусовую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную концентрированной соляной кислотой. Что вы наблюдаете? Напишите уравнения реакции. -Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа ее вверх дном (конец газоотводной трубки сразу же после снятия с нее пробирки с аммиаком закройте кусочком мокрой ваты). -Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. 4.Описание и результаты опытов занесите в таблицу:
5. Приведите своё рабочее место в порядок ИНСТРУКЦИОННАЯ КАРТА Практическая работа № 6 «Получение, собирание, распознавание газов» Вариант 2. Цель: основываясь на знаниях, полученных в 8-9 классе повторить технику получения водорода и углекислого газа, вспомнить свойства полученных веществ. Оборудование: штатив большой лабораторный, муфта, лапка, пробирки, пробка с газоотводной трубкой, лучинка, горелка (спиртовка), спички. Реагенты: цинк, соляная кислота, карбонат кальция, раствор гидроксида кальция Техника безопасности: - Будьте осторожны с растворами щелочей, кислот, солей -Обязательно проверьте водород на чистоту - Опасайтесь растрескивания пробирки при её нагревании - Соблюдайте правила работы со спиртовкой (горелкой) - Работу проводить только над лотком -Запрещается оставлять неубранными разлитые и рассыпанные реагенты. Ход работы 1.Запишите в тетради тему практического занятия и вариант. 2.Опыт № 1. Получение углекислого газа - Соберите прибор как показано на рисунке: 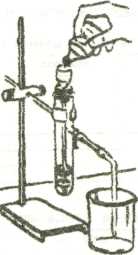 -В пробирку внесите несколько кусочков мела и прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой - Соберите газ в химический стакан вытеснением воздуха и докажите, что газ собран. - Пропустите газ в раствор лакмуса. Какую среду (кислую, щелочную или нейтральную ) образует водный раствор оксида углерода (IV)? - Пропустите углекислый газ в известковую воду до появления признаков реакции. Отлейте пробу этого раствора и пропустите в него избыток углекислого газа. От вновь полученного раствора отлейте пробу и прокипятите. Что наблюдаете? Уравнения реакций составьте в молекулярном и ионном виде. 3.Опыт № 2. Получение водорода - Соберите прибор для получения газа, проверьте его на герметичность -Пробирку положите 3-4 гранулы цинка и прилейте 3-4 мл раствора соляной кислоты -Закройте пробкой с газоотводной трубкой . -Соберите водород, держа пробирку отверстием вниз ( почему?) -Проверьте водород на чистоту: не переворачивая пробирку, внесите её горячую лучинку. Лёгкий хлопок указывает на чистоту собранного водорода, свистящий лающий звук – на наличие примесей - Перелейте водород из одной пробирки в другую и подтвердите, что газ находиться во второй пробирке 4.Описание и результаты опытов занесите в таблицу:
Критерии оценивания результатов обучения учащихся Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению. Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов: глубина (соответствие изученным теоретическим обобщениям); осознанность (соответствие требуемым в программе умениям применять полученную информацию); полнота (соответствие объему программы и информации учебника). При оценке учитываются число и характер ошибок (существенные или несущественные). Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления причинно-следственных связей, сравнения и классификации явлений и т. п.). Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним можно отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона). Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента. Оценка теоретических знаний Отметка «5»: ответ полный и правильный на основании изученных теорий; материал изложен в определенной логической последовательности, литературным языком; ответ самостоятельный. Отметка «4»: ответ полный и правильный на основании изученных теорий; материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя. Отметка «3»: ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный. Отметка «2»: при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя. Оценка экспериментальных умений Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу. Отметка «5»: работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы; эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием; проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы). Отметка «4»: работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием. Отметка «3»: работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя. Отметка «2»: допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя. Оценка умений решать экспериментальные задачи Отметка «5»: план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования; дано полное объяснение и сделаны выводы. Отметка «4»: план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования, при этом допущено не более двух несущественных ошибок в объяснении и выводах. Отметка «3»: план решения составлен правильно; правильно осуществлен подбор химических реактивов и оборудования, но допущена существенная ошибка в объяснении и выводах. Отметка «2»: допущены две (и более) существенные ошибки в плане решения, в подборе химических реактивов и оборудования, в объяснении и выводах. Оценка умений решать расчетные задачи Отметка «5»: в логическом рассуждении и решении нет ошибок, задача решена рациональным способом. Отметка «4»: в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок. Отметка «3»: в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах. Отметка «2»: имеются существенные ошибки в логическом рассуждении и решении. Оценка письменных контрольных работ Отметка «5»: ответ полный и правильный, возможна несущественная ошибка. Отметка «4»: ответ неполный или допущено не более двух несущественных ошибок. Отметка «3»: работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные. Отметка «2»: работа выполнена менее чем наполовину или содержит несколько существенных ошибок. При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима. Критерии оценивания письменных контрольных работ
8.Описание материально-технического обеспечения образовательного процесса Основная литература 1. Гара Н.Н. Программы общеобразовательных учреждений. Химия. 8-9 классы. 10-11 классы – М.: Просвещение», 2008 2. Рудзитис Г.Е. Химия: основы общей химии: учебник для 11 кл. общеобразоват. учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г.Фельдман. - М.: Просвещение, 2009. – 159 с. (номер в федеральном перечне 1.3.5.3.4.2) 3. Гара Н.Н. Химия: уроки в 10 кл.: пособие для учителя. – М.: Просвещение, 2008. – 11 с. 4. Рудзитис Г.Е., Фельдман Ф.Г.Химия. Органическая химия. 10 класс. Учебник для общеобразовательных учреждений.- М.: Просвещение, 2009.- 192 с. (номер в федеральном перечне 1.3.5.3.4.1) Дополнительная литература 1. Гаркуша Н. С. Карты - инструкции для практических занятий по химии: методическое пособие для учащихся 8-11 классов. – Ст. Оскол.: ИПК «Квадрат», 2004 2. Горбунцова С. В. «Тесты и ЕГЭ по основным разделам школьного курса: 10-11классы» – М.: «ВАКО», 2006 3.Доронькин В.Н. Химия. Карманный справочник.9-11 классы: учебно-методическое пособие/В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А.Февралёва. – Ростов н/Д: Легион, 2013.- 336 с. – (Готовимся к ЕГЭ). 4. В.Н. Доронькин, А.Г. Бережная, Т.В. Сажнева, В.А.Февралёва Химия. Подготовка к ЕГЭ-2014:учебно-методическое пособие/ Под ред. В.Н. Доронькина. – Ростов н/Д: Легион, 2014. -336 с. – (Готовимся к ЕГЭ). 5. Каверина А.А. ЕГЭ 2010 .Химия Федеральный банк экзаменационных материалов/Ав.сост.А.А.Каверина, Ю.И.Медведев,Д.Ю.Добротин. – М.: Эксмо, 2010 6. Корощенко А.А.Самое полное издание типовых вариантов реальных заданий ЕГЭ:2009. Химия /авт-сост.А.А.Корощенко,М.Г.Снастина - М.: АСТ:Астрель,2009 7. Радецкий А.М., Горшкова В.П., Кругликова Л.Н. Дидактический материал по химии для 10 классов: пособие для учителя. – М.: Просвещение, 2008. – 79 с. 8. Третьяков Ю.Д. и др. Химия. Справочные материалы. Книга для учащихся. М.: Просвещение, 1993 9. Хомченко И.Г. Сборник задач и упражнений для средней школы. – М.: «Издательство Новая Волна», 2009 MULTIMEDIA – поддержка предмета Виртуальная школа Кирилла и Мефодия. Уроки химии. 10-11 классы. – М.: ООО «Кирилл и Мефодий», 2008 Интернет-ресурсы 1.https://school-collection.edu.ru 2. https://fcior.edu.ru 3.https://window.edu.ru 4.https://school.edu.ru 5 .https://openclass.ru 6. https://fipi.ru/view Оборудование 1.Набор химических реактивов
3. Набор коллекций
4. Комплект химического лабораторного оборудования
|
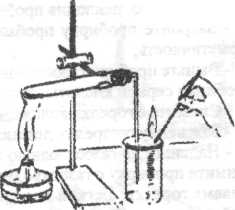 ставьте в отверстие пробирки с перманга-
ставьте в отверстие пробирки с перманга-