Лабораторная работа №4 Получение газов и изучение их свойств Цель: получить кислород, водород, углекислый газ и изучить их свойства
 Скачать 34.87 Kb. Скачать 34.87 Kb.
|
Лабораторная работа №4 Получение газов и изучение их свойств Цель: получить кислород, водород, углекислый газ и изучить их свойства Оборудование и реактивы: Zn, HCl, CaCO3, H2SO4, Ca(OH)2, KMnO4, пробирки, газоотводные трубки, штатив, спиртовка, лучина, спички. Ход работы Получение водорода и изучение его свойств 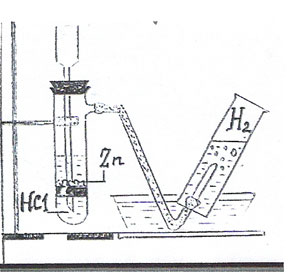 Водород входит в состав кислот, оснований, кислых и основных солей и наиболее распространенного на Земле вещества – воды. Он применяется как восстановитель при получении металлов и во многих органических синтезах. В недалеком будущем водород будет использоваться как горючее вместо бензина, керосина, мазута, газа и угля, так как при его горении не образуется вредных примесей. Водород в промышленности получают конверсией метана, электролизом воды, а в лабораториях – из кислот при их взаимодействии с металлами.
Запишите уравнения реакций. Напишите вывод. Вопросы для вывода:
Получение оксида углерода (IV) и изучение его свойств Главным потребителем углекислого газа является пищевая промышленность: производство сахара, пива, газированной воды. Он применяется также в качестве хладоагента (сухой лед), для тушения пожаров и в качестве нагнетающего газа для перекачки легковоспламеняющихся жидкостей. В химической промышленности диоксид углерода используется при получении кальцинированной соды – карбоната натрия Na2CO3.
Запишите уравнения реакций в молекулярном, полном и сокращенном ионном виде. Напишите вывод. Вопросы для вывода:
Получение кислорода и изучение его свойств Кислород – самый распространенный на Земле химический элемент: около половины (47 % по массе) вещества земной коры приходится на кислород. Без кислорода невозможна жизнь, так как он поддерживает дыхание человека и животных. С его помощью сжигают топливо, получая тепло и электроэнергию. Кислород содержится в воздухе и в химических соединениях – воде, оксидах, гидроксидах, солях, органических веществах. Для промышленных целей кислород получают ректификацией жидкого воздуха, а в лабораториях – из веществ, которые при нагревании разлагаются с его выделением (KMnO4, KClO3, BaO2). 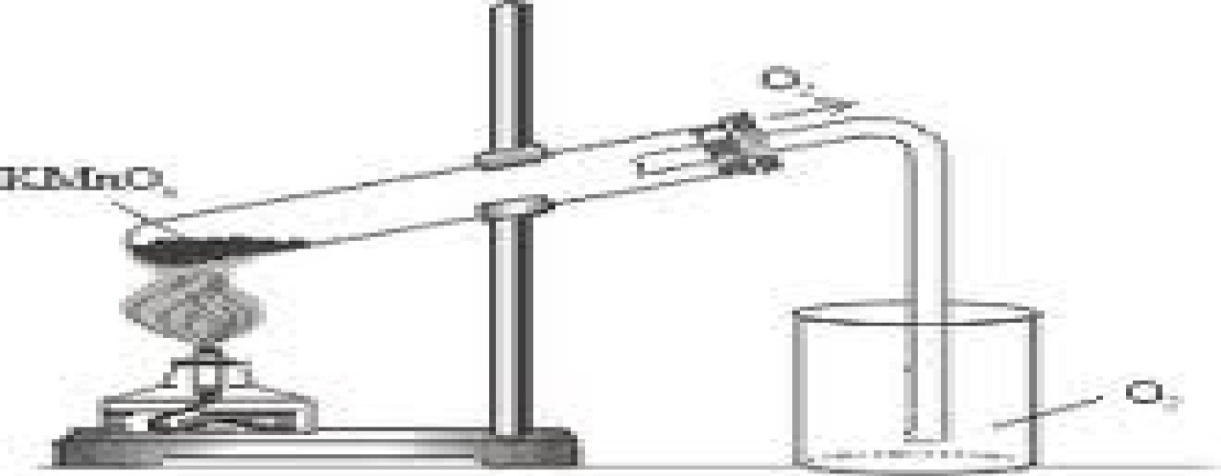 Прибор для получения и сбора кислорода
Запишите уравнения реакций. Напишите вывод. Вопросы для вывода:
|