циклонный пылеуловитель с двойной фильтрацией проводят диагностику, ремонт и гарантийное обслуживание систем аспирации. Если требуется только приобрести фильтр из каталога компании, то инженеры ООО «Экофильтр» помогут осуществить выбор пылеуловителя, подходящего под конкретные производственные задачи. Получить консультацию или сделать заказ можно в одном из офисов компании либо по телефону:
Тема: Химические свойства простых и сложных веществ. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат- ионы, ион аммония).
 Скачать 57.97 Kb. Скачать 57.97 Kb.
|
Тема: Химические свойства простых и сложных веществ. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат- ионы, ион аммония). Качественные реакции на газообразные вещества (водород, кислород, углекислый газ, аммиак). Получение газообразных веществ. Задания для тренировки:
9) В лаборатории в неподписанной банке хранится белое кристаллическое вещество. Для определения его состава провели три качественные реакции. Это вещество при нагревании полностью разлагается без образования сухого остатка. При действии горячего раствора гидроксида натрия выделяется бесцветный газ с резким запахом, вызывающий посинение лакмусовой бумаги. При действии меди и концентрированной серной кислоты при нагревании выделяется бурый газ. Напишите формулу вещества и запишите три уравнения реакций, проведённых для распознавания этого вещества. 10) На занятиях химического кружка учащиеся исследовали порошкообразное вещество белого цвета. При добавлении к веществу гидроксида калия и последующего нагревания выделяется бесцветный газ с резким запахом, при горении образующий азот. При растворении исследуемого вещества в воде и добавлении к нему раствора нитрата серебра образуется белый осадок, не растворимый в кислотах. Напишите формулу вещества и запишите три уравнения реакций, проведённых для распознавания этого вещества. 11) Бесцветные кристаллы некоторого вещества растворили в воде. При добавлении к пробе полученного раствора нитрата бария выпадает белый кристаллический осадок. Если к этому осадку добавить раствор азотной кислоты, то произойдёт бурное выделение газа. При добавлении к другой пробе раствора исследуемого вещества гидроксида натрия появляется резкий запах, а поднесенная к отверстию пробирки лакмусовая бумажка окрашивается в синий цвет. Напишите формулу вещества и запишите три уравнения реакций, проведённых для распознавания этого вещества.
Ответы к заданиям
|
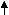
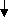 O2 + Ca(OH)2 = CaCO3 + H2O
O2 + Ca(OH)2 = CaCO3 + H2O NaHCO3 t Na2CO3 + CO2 + H2O
NaHCO3 t Na2CO3 + CO2 + H2O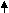
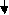 H4Cl + AgNO3 = AgCl + NH4NO3
H4Cl + AgNO3 = AgCl + NH4NO3 2SO4 +2 NaHCO3= Na2SO4 + H2O + CO2
2SO4 +2 NaHCO3= Na2SO4 + H2O + CO2