Гидролиз солей
Гидролиз солей - это разложение вещества при взаимодействии с водой (соль должна быть растворима!).
Если рассматривать соль как продукт взаимодействия основания кислоты, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
Сильные металлы (образующие сильные основания)
|
Сильные кислоты (образующие сильные кислотные остатки)
|
Ме IA и IIA (начиная с Са):
Li, Na, K, Rb, Cs, Fr
|
HCl, HBr, HI, HNO3, HClO4, HMnO4, H2SO4
|
1) Гидролиз по аниону (I тип)
Соль, образованная сильным основанием и слабой кислотой (КClO4, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы.
K2SiO3 + Н2О <=>KHSiO3 + KОН
K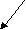 2SiO3 <=> 2K+ +SiO32- 2SiO3 <=> 2K+ +SiO32-
Н2О <=> Н+ + ОH-
-  ----------------------------------------------------- -----------------------------------------------------
 НSiO3- + 2K+ + ОН- НSiO3- + 2K+ + ОН-
Среда раствора – щелочная.
2) Гидролиз по катиону (II тип)
Соль, образованная слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион, в результате чего образуется слабый электролит, ион H+ и другие ионы.
F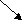 eCl2 + H2O <=>Fe(OH)Cl + HCl eCl2 + H2O <=>Fe(OH)Cl + HCl
FeCl2 <=> Fe2+ + 2Cl-
Н2О <=> Н+ + ОH-
------------------------------------------------------
 
FeOH+ + 2Cl- + Н+
Среда раствора – кислая
3) Гидролиз по катиону и аниону одновременно (III тип)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Al2S3 => 2Al3+ + 3S2-
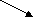 
Н2О <=> Н+ + ОH-
------------------------------------------------------
Формулы веществ составляем по валентностям элементов.
Среды этих растворов может быть нейтральной (чаще всего), слабокислой или слабощелочной
4) Гидролиз невозможен (IV тип)
Соль, образованная сильным основанием и сильной кислотой
(KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
| |
 Скачать 23.29 Kb.
Скачать 23.29 Kb.