
Характеристика химического элемента-металла на основании его положения в ПСХЭ Д.И.Менделеева
Цели урока Повторить строение атома, типы хим. связи, классификацию неорганических веществ и их свойства в свете ТЭД и ОВР, генетическую связь между классами неорганических веществПознакомить учащихся с задачами на выход продукта реакции

Адрес ХЭСтроение атома, проявляемые свойства, сравнение с соседними элементамиФизические свойства простого веществаОксид, образуемый этим ХЭ и его свойства, тип и схема хим. связиГидроксид, образуемый этим ХЭ, его свойства, тип связиВодородное соединение, его свойстваСоли и их свойства

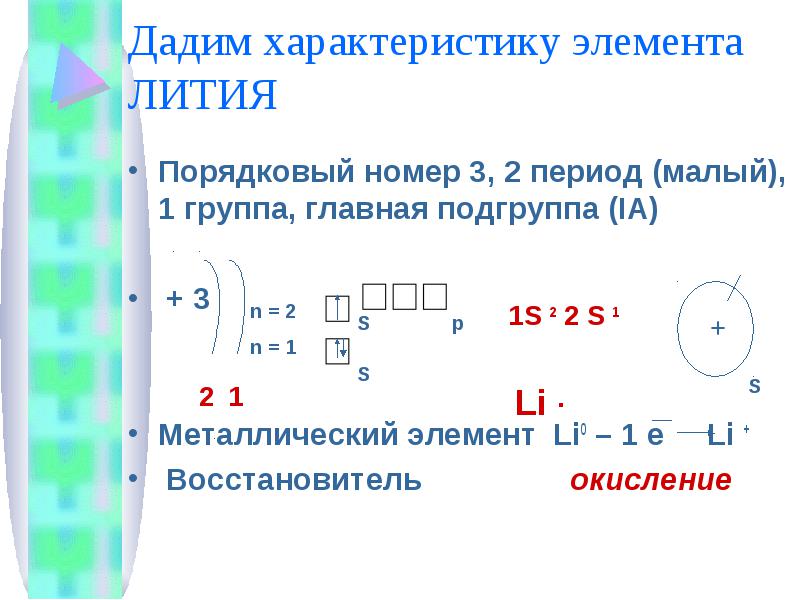
Порядковый номер 3, 2 период (малый), 1 группа, главная подгруппа (IA) + 3Металлический элемент Li0 – 1 e Li + Восстановитель окисление
Сравним свойства атома лития с соседними ХЭ по группе и периоду В группе : Литий - НатрийНа внешней оболочке – по 1 электрону (сходство)Количество оболочек: у натрия на 1 оболочку больше, следовательно, радиус атома натрия больше, чем у лития, металлические и восстановительные свойства натрия сильнееВ периоде: Литий – БериллийКоличество оболочек – по 2 (сходство)Количество внешних электронов: у лития 1e, а у натрия – 2 e, следовательно, радиус атома лития больше, чем у бериллия, металлические и восстановительные свойства лития сильнее

Литий – простое вещество Щелочной металл серебристого цвета, очень легкий, хранится под слоем керосина, не встречается в природе в свободном виде, малиновый цвет пламениТ пл. = 180,60, Т кип. = 13420, плотность 0,534 г/ cм3Металлическая кристаллическая решеткаМеталлическая хим. связьLi0 – 1 e Li + атом ион Электропроводность, теплопроводность, ковкость, пластичность, металлический блеск, режется ножом, но на срезе быстро окисляется и темнеет из-за своей активностиХимические свойства: реагирует с водой и неметаллами (кислородом, азотом, галогенами, водородом и др.) – составить уравнения реакций

Оксид лития – Li2O Солеобразующий, основныйИонная связь (записать схему образования связи)Белый цветХимические свойства: Запишите реакции оксида лития с водой, оксидом углерода (IV), соляной кислотойПолучение: Li2O2 + 2 Li = 2 Li2O

Гидроксид лития - LiOH Li+ - OH- ионная связьLi+ - простой ион, OH- - сложный ионOH- - КПСБелый гигроскопичный порошок, мылкий на ощупь, едкийХимические свойства: запишите реакции гидроксида лития с серной кислотой, сульфатом меди (II), оксидом углерода (IV), исключение – разложение при нагреванииПолучение: электролиз расплавов галогенсодержащих солей 2 LiCl 2 Li + Cl2

Водородное соединение – LiH гидрид лития ТвердыйБелыйГигроскопиченИспользуется как восстановительCоли лития

Открытие лития А.Арфведсон, 1817 г. – признал литий новым щелочным металломВпервые выделен из слоистого силикатного минерала петалита LiAlSi4O10Название – от греческого «камень»Г.Дэви, 1818 г., электролиз расплавленного оксида лития

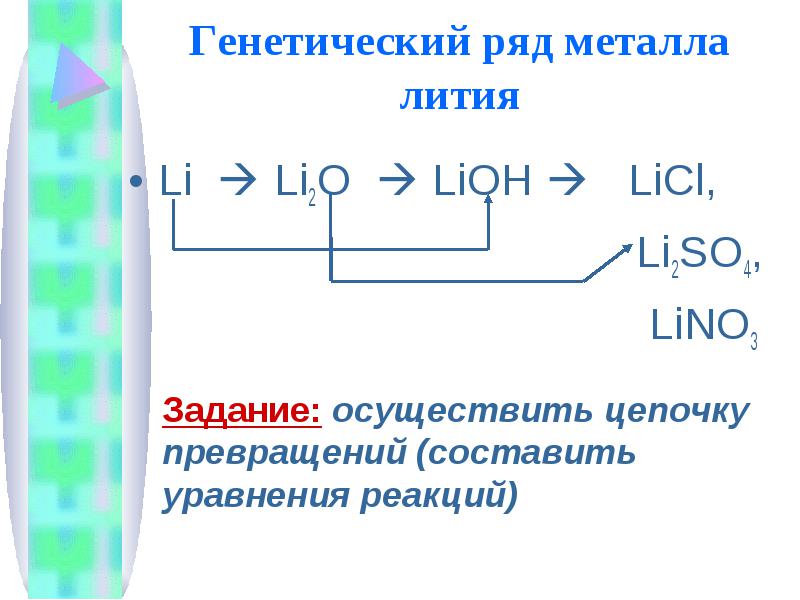
Генетический ряд металла Вспомните признаки генетического ряда:Один и тот же химический элемент-металлРазные формы существования этого элемента-металла (простое вещество-оксид-основание-соль)

Генетический ряд металла лития Li Li2O LiOH LiCl, Li2SO4, LiNO3
Задачи на примеси и выход продукта реакции Найдите объем углекислого газа (н.у.), который можно получить взаимодействием 250 г известняка, содержащего 20% примесей, с избытком азотной кислоты.Можно ли получить весь 100%-ный объем?Найти объем углекислого газа, если выход газа составил 75% от теоретически возможного.

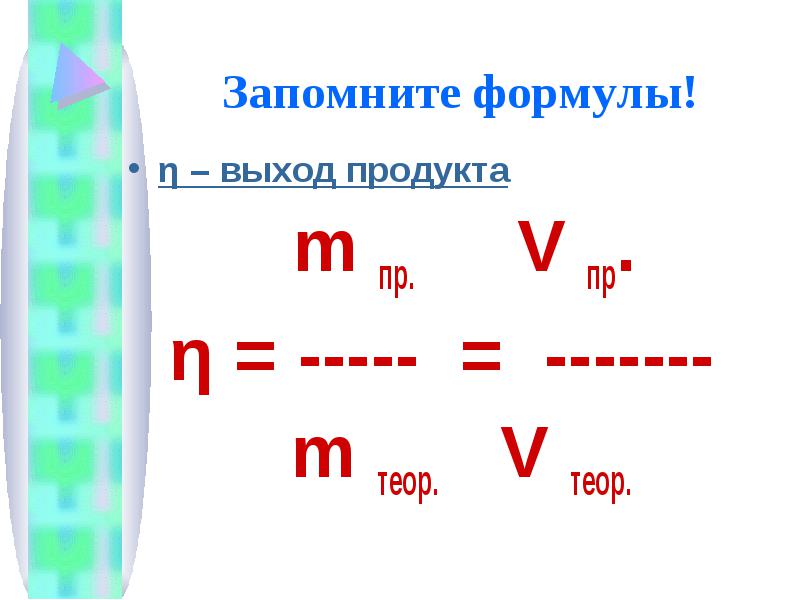
Запомните формулы! η – выход продукта m пр. V пр. η = ----- = ------- m теор. V теор.
Домашнее задание § 1, упражненияРешить задачу.При взаимодействии 800 мг 30%-ного раствора едкого натра с избытком раствора медного купороса (сульфата меди (II)) было получено 196 мг осадка. Каков его выход в % от теоретически возможного?
 |
 Скачать 445 b.
Скачать 445 b.













