Муниципальный этап Всероссийской олимпиады школьников по химии 2010/2011 г. Восьмой класс. Задача 8-1
 Скачать 91.13 Kb. Скачать 91.13 Kb.
|
| Муниципальный этап Всероссийской олимпиады школьников по химии 2010/2011 г. Восьмой класс. Задача 8-1. Атом элемента А имеет массу в 14 раз большую, чем атом элемента В. В соединении этих элементов на 100 г элемента А приходится 21,4 г элемента В. Определите, сколько атомов элемента В приходится на один атом элемента А в их соединении и напишите простейшую химическую формулу этого соединения. О каких элементах может идти речь, если известно, что они располагаются в пределах первых трех периодов периодической системы Д.И.Менделеева? (10 баллов) Задача 8-2. Распределите вещества, которые могут встретиться в повседневной жизни на простые и сложные, а сложные отнесите к известным вам классам веществ (оксиды, кислоты, основания, соли): алюминий, углекислый газ, гашеная известь, мрамор, сода, кислород, ржавчина, уксус, железо, мел. Ответ дайте в форме таблицы:
(10 баллов) Задача 8-3. Многие химические превращения можно отнести к одному из следующих четырех типов: реакции соединения; реакции разложения; реакции замещения; реакции обмена. Далее приведены уравнения 10 химических реакций. Проанализируйте их и постарайтесь определить, к какому типу относится каждая реакция.
Ответ дайте в форме таблицы, указав номера реакций в нужной колонке:
(10 баллов) Задача 8-4. У вас есть три баночки, в каждой из которых находится смесь двух веществ. Ваша задача - разделить каждую смесь и поместить чистые вещества в новые баночки. Кратко опишите, как вы это будете делать для следующих смесей: а) смесь порошка мела и поваренной соли; б) раствор поваренной соли в воде в) смесь песка и древесных опилок. Какие процессы, физические или химические, вы использовали для разделения смесей? (10 баллов) Задача 8-5. Природный минерал, фосфорит, содержит в качестве основного вещества фосфат кальция, химическое соединение, формула которого Ca3(PO4)2. а) Сколько атомов каждого элемента в структурной частице этого соединения? б) Чему равна относительная молекулярная масса этого вещества? в) Чему равна массовая доля каждого химического элемента в этом веществе? г) В каком веществе содержание кальция выше, в фосфате кальция или в гидроксиде кальция Ca(OH)2? Для подтверждения ответа рассчитайте, сколько кальция содержится в 5 г фосфата кальция и сколько - в 5 г гидроксида кальция. (10 баллов) Муниципальный этап Всероссийской олимпиады школьников по химии 2010/2011 г.Девятый класс.Задача 9-1.На растворение смеси, состоящей из железа и оксида железа(III) израсходовано 133 мл 20%-ной соляной кислоты (плотность 1,096 г/мл). Выделившийся при этом газ образует при сгорании 1,2*1023 молекул воды. Определите массовую долю железа в смеси. (10 баллов) Задача 9-2.Юный химики Вася и Маша решили вырастить кристалл медного купороса (CuSO4*5H2O). Быстро рассчитав, сколько нужно взять медного купороса и воды, они приготовили 200 г насыщенного раствора сульфата меди, опустили в него на тонкой ниточке маленький кристаллик-затравку, и поставили все это в теплое место. Время шло, вода из раствора потихоньку испарялась, а кристаллик все рос и рос. Когда через неделю Вася и Маша вытащили из раствора прекрасный голубой кристалл, обсушили и взвесили, то его масса оказалась равной 6,35 г. Вопросы: а) Сколько медного купороса и воды было использовано для приготовления 200 г насыщенного раствора, если массовая доля сульфата меди в нем равна 17%? б) Сколько воды испарилось из раствора за время роста кристалла? (массой затравки можно пренебречь) в) А юный химик Петя решил повторить этот эксперимент, налил такой же раствор в алюминиевую кружку, опустил затравку, поставил в теплое место… Но спустя некоторое время его ожидал неприятный сюрприз. Опишите, что произошло и напишите уравнение реакции. (10 баллов) Задача 9-3.В замкнутом сосуде смешали водород, кислород и хлор. Плотность полученной газовой смеси по азоту составила 0,4625. Известно, что в смеси содержится в 14 раз больше по объему водорода, чем хлора. Смесь газов взорвали и охладили. Определите состав исходной смеси (объемные доли) и массовую долю кислоты в растворе, который обнаружили в сосуде. (10 баллов) Задача 9-4.В 5 склянках без этикеток находятся растворы следующих веществ: KOH, Na2CO3, HCl, Al2(SO4)3, KCl а) Какие из этих веществ могут взаимодействовать между собой? Напишите молекулярные и краткие ионные уравнения соответствующих реакций. б) Опишите, как распознать растворы этих веществ, не используя других химических реактивов (последовательность действий, наблюдения, выводы). в) Один из осадков, получаемых при взаимодействии этих растворов, растворяется в избытке одного из исходных веществ. Что это за осадок и как объяснить растворение осадка (уравнение реакции). (10 баллов) Задача 9-5.Н 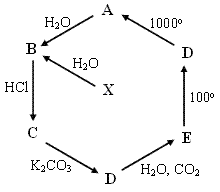 а схеме показаны превращения соединений химического элемента X. Известно также, что соединение D, присутствующее на схеме, в природе образует минерал "известняк". а схеме показаны превращения соединений химического элемента X. Известно также, что соединение D, присутствующее на схеме, в природе образует минерал "известняк". а) Определите элемент X и назовите вещества, обозначенные буквами, напишите уравнения реакций. б) Есть ли среди этих реакций окислительно-восстановительная? Если да, укажите для нее окислитель и восстановитель, напишите электронные уравнения. (10 баллов) Муниципальный этап Всероссийской олимпиады школьников по химии 2010/2011 г.Десятый класс.Задача 10-1.При проведении реакции между 100 мл раствора гидроксида натрия и 50 мл соляной кислоты с концентрациями соответственно 1 моль/л и 1,5 моль/л, температура жидкости поднялась на 6,67oС. Считая, что плотности растворов равны 1, а их удельная теплоемкость 4,18 Дж/г*град, рассчитайте тепловой эффект реакции нейтрализации и напишите термохимическое уравнение реакции. Как изменится тепловой эффект реакции, если соляную кислоту заменить азотной? Уксусной? Объясните, почему. (10 баллов) Задача 10-2.Смесь карбида алюминия и сульфида алюминия обработали избытком раствора гидроксида натрия, при этом смесь полностью растворилась, и выделилось 6,72 л газа (н.у.) Через полученный раствор пропустили углекислый газ до прекращения выпадения осадка, масса которого после прокаливания составила 40,8 г. Напишите уравнения реакций. Определите массовые доли веществ в исходной смеси. (10 баллов) Задача 10-3.Смесь ацетилена и пропана объемом 3,5 л (н.у.) с плотностью по гелию, равной 8,3, сожгли в избытке кислорода. Продукты реакции пропустили через склянку с концентрированной серной кислотой и затем через склянку с 0,5 л водного раствора гидроксида натрия с плотностью 1,066 г/мл и массовой долей щёлочи 3%. Определите массовые доли веществ, находящихся в полученном при этом растворе. (10 баллов) Задача 10-4.Неправильное использование минеральных удобрений привело к загрязнению озера: зафиксировано превышение предельно допустимой концентрации (ПДК) по азоту в 70 раз (ПДК(N) = 2мг/л). Рассчитайте число атомов азота, содержащихся в 1 литре озерной воды, а также молярную концентрацию аммиачной селитры, которая могла быть источником такого загрязнения. Какие массы азотной кислоты и аммиака были напрасно истрачены для получения удобрения, если объем озера оценивается в 60000 м3? Чем обусловлено применение удобрений при возделывании сельскохозяйственных культур? Какие три основных вида минеральных удобрений вы знаете? Приведите примеры (названия и формулы) веществ, используемых в качестве удобрений. (10 баллов) Задача 10-5.После занятия химического кружка восьмиклассников в лаборатории осталось пять колб с растворами. На первой колбе было написано "иодид калия", на второй - "карбонат калия", на третьей - "соляная кислота", на четвертой - "хлорид меди" и на пятой - "гидроксид бария". Десятиклассники Маша и Саша сразу увидели, что что-то здесь не так - колба с хлоридом меди была подписана неправильно. "Надо проверить и другие растворы" - решили друзья, и поспорили, кто это сделает быстрее. Маша взяла немного раствора из первой колбы, и прилила к ней раствор из второй. Выделился газ. Тогда Маша к раствору из первой колбы прилила раствор из третьей - выпал белый осадок. "Этого достаточно" - решила Маша и подошла к Саше. А Саша к этому времени уже налил немного растворов из четырех колб в четыре пробирки и прибавил к ним уже известный раствор хлорида меди. В одной пробирке у него раствор стал темно-коричневым и выпал желтый осадок, в другой был осадок синего цвета, еще в одной - зеленоватый, и только в одной - ничего не произошло. "Мне тоже все понятно!" - сказал он. А у восьмиклассников остались вопросы: а) Как Маша и Саша сразу поняли, что хлорид меди подписан неправильно? б) Какие реакции провела Маша? Напишите молекулярные и ионные уравнения реакций. На основании ее опытов определите, в какой колбе находился какой раствор. в) Какие реакции провел Саша? Напишите уравнения и этих реакций. г) Есть ли среди проведенных реакций окислительно-восстановительные? Если да, укажите окислитель и восстановитель, напишите электронные уравнения. (10 баллов) Муниципальный этап Всероссийской олимпиады школьников по химии 2010/2011 г.Одиннадцатый класс.Задача 11-1.К 5.44%-ному раствору хлорида цинка массой 550г, добавили 250 мл раствора гидроксида натрия, гетерогенную смесь перемешали и отделили осадок. При прокаливании осадка образовалось бинарное соединение массой 8,1 г. Определите молярную концентрацию раствора щелочи, если раствор оставшийся после отделения осадка имел а) кислую среду, б) щелочную среду. Почему раствор мог иметь кислую или щелочную среду? Объясните, написав ионные уравнения соответствующих реакций. (10 баллов) Задача 11-2.Кристаллогидрат щавелевой кислоты H2C2O4*2H2O содержащий 1% примесей, решили очистить перекристаллизацией. Для этого из 70 г его приготовили насыщенный при 80oС раствор щавелевой кислоты, который затем охладили до 0oС. При этом из раствора выпал очищенный кристаллогидрат, а примеси остались в растворе. Известно, что растворимость щавелевой кислоты в воде при 80oС равна 84,5 г, а при 0oС 3,52 г на 100 г воды. Рассчитайте, сколько воды пришлось взять для приготовления насыщенного раствора? Чему равна масса очищенного кристаллогидрата, выпавшего при охлаждении раствора? (10 баллов) Задача 11-3.Один моль смеси этилена с водородом, имеющий плотность по водороду 9, нагрели в замкнутом сосуде объемом 10 л с платиновым катализатором до установления равновесия, при этом давление в сосуде уменьшилось на 20 %. а) Определите выход продукта реакции в % от теоретически возможного. б) Рассчитайте, величину константы равновесия данного процесса. в) Как изменения произойдут в сосуде, если после достижения равновесия, открыв вентиль, выпустить из него часть газов? (10 баллов) Задача 11-4.Смесь 2,97 г порошка алюминия и 5,6 г порошка серы нагрели до полного протекания реакции. Полученную массу измельчили и обработали 120 мл 15%-ной соляной кислоты (плотность 1,075 г/мл). При этом выделялся дурнопахнущий газ, а часть смеси так и не растворилась. Определите массу нерастворившегося вещества, и массовые доли веществ в полученном растворе (растворимостью газа можно пренебречь). (10 баллов) Задача 11-5.Простое вещество А красного цвета энергично взаимодействует с концентрированным раствором вещества Б. При этом получается бесцветный раствор вещества В, которое, в зависимости от количества добавленной щелочи образует вещества Г, Д, или Е. Газ Ж, полученный в первой реакции тоже дает с раствором щелочи два продукта: З и К. Определите вещества А-К и назовите их, напишите уравнения реакций. Для окислительно-восстановительных реакций укажите окислитель и восстановитель, напишите электронные уравнения. (10 баллов) |