Исследовательская работа: «Благородный Гелий или Солнечное вещество»
 Скачать 189.61 Kb. Скачать 189.61 Kb.
|
| Научно-практическая конференция «Купчинские юношеские чтения» Секция «Химия» ГОУ СОШ №359 Исследовательская работа: «Благородный Гелий или Солнечное вещество» Афанасьева М.А. Ученица 9А класса Научный руководитель: Тереньтева Е.В. Учитель химии ГОУ №359 Санкт-Петербург 2013 Содержание: Введение_______________________________________________3 Глава 1 §1_____________________________________________________4 §2_____________________________________________________6 §3____________________________________________________10 §4____________________________________________________11 §5____________________________________________________12 Глава 2 §1____________________________________________________13 Интересные факты_____________________________________15 Заключение_____________________________________________16 Список литературы_____________________________________17 Введение В моей работе пойдёт речь о гелии, а именно: о его свойствах, физических и химических, о получении гелия и его применении, а так же о некоторых интересных фактах, связанных с ним. Гелий – это, пожалуй, самое загадочное вещество в мире. Интересно, что современный среднестатистический человек толком ничего о гелии не знает, кроме того, что им наполняют шарики. Это связано с тем, что гелий всё ещё малоизучен и практически не поддаётся изучению и с тем, что большинство имеющейся информации о данном веществе засекречено, так как гелий используют в секретных научных разработках. В своей работе я опираюсь на доказанные факты, научные опыты и уже существующие исследовательские работы о гелии, а так же на информацию, полученную мной из различных источников: энциклопедий, справочников, Интернет сайтов и других. Очень многие учёные исследовали гелий: Жансен, Локьер, Рамзай, Крукс, Резерфорд, Пальмиери, Кеезом, Камерлинг-Оннес, Фейнман, Онсагер, Капица, Кикоин, Ландау и многие другие. Возможно, тема, связанная гелием на данный момент менее актуальна, чем тема, связанная с металлами или другими веществами, которые часто используются в промышленности. Однако я выбрала именно эту тему, потому что гелий – подлинно благородный газ, и для меня это действительно увлекательно. Глава 1 §1 История открытия. История открытия гелия очень интересна. Английский физик Рэлей и химик Рамзай пытались извлечь примесь из воздушного азота. Для этого они решили повторить опыт Кавендиша, но в гораздо больших масштабах. В стеклянный баллон были впаяны две проволоки, внутри баллона между концами проволок оставалось расстояние в несколько сантиметров. Наружные концы проволок торчали из баллона. Рэлей соединил их с высоковольтным трансформатором. При включении электрического напряжения внутри баллона возникали электрические искры. Рэлей накачал в баллон несколько литров азота и кислорода, а потом начал вгонять туда раствор едкого натра. Едкий натр врывался в баллон и вытекал из него по особой стеклянной трубочке. В тоже время включалось электрическое напряжение. Возникали искры, и под действием этих искр азот вступал в химическое соединение с кислородом. Через несколько часов весь азот, который был в баллоне, соединился с кислородом и ушёл из баллона вместе со струёй едкого натра. Азот ушёл из баллона, но внутри по-прежнему оставался газ. На это указывал манометр – прибор, которым измеряют давление газа на стенки сосуда. Этот газ не соединялся с кислородом, не растворялся в едком натре. Рэлей тщательно просушил и профильтровал новый газ, продувая его через фарфоровую трубку с горячими медными опилками. Горячие медные опилки очистили газ от остатков кислорода. 12 августа 1894 года Рэлей выступил с докладом о новом веществе в Британской ассоциации содействия науке. А позже элемент был назван аргоном (от греч. «аргос» - «ленивый»). Но возникла проблема с размещение аргона в периодической системе Менделеева. Периодическая система элементов являла собой удивительное целостное строение: открытие аргона могло привести к тому, что всё её здание рухнет. Аргон не имел в таблице аналогов. Куда же можно поместить элемент, лишённый свойств? Ответ на этот вопрос пришёл не сразу. Прежде всего, вспомнили об открытии 1868 года француза Пьера Жюля Сезара Жансена и англичанина Джозефа Нормана Локьера. Эти учёные с помощью спектроскопа изучали спектр солнечных протуберанцев и обнаружили в нём жёлтую линию, принадлежавшую новому элементу. Официальное название элемент получил лишь четверть века спустя, после того как гелий был открыт на Земле. В 1895 году Рамзай при обработке очень редкого минерала клевеита серной кислотой обнаружил газ, спектральный анализ которого показал, что это «земной» гелий. Как установили позже, гелий непрерывно образуется в минерале в результате радиоактивного распада урана. Позже Рамзай открыл ещё несколько «благородных» газов: Неон, Криптон и Ксенон. Так в периодической системе появилась так называемая «нулевая группа». Электронное строение. После открытия «благородных» газов и создания «нулевой группы» периодическая система приобрела более законченный вид. С развитием представлений об электронном строении атомов стало ясно, что инертные газы имеют целиком заполненные s- и p-подуровни. На единственном электронном уровне гелия располагаются два электрона, а остальные представители группы являются p-элементами, и у них на внешнем электронном уровне находятся по восемь электронов. Поэтому с точки зрения электронного строения гелий можно было отнести к s-элементам и поставить в группу IIA. Однако он настолько непохож не элементы II группы, что его оставили в VIII группе вместе с подобными ему газами. Все электроны в атомах гелия очень прочно связаны с ядром, поэтому этот элемент не вступает в химические реакции. §2 Физические свойства. Гелий обладает самой низкой температурой кипения и плавления. Перевести его в твердое состояние удаётся только при давлении порядка 25*10^5 Па. Жидкий гелий впервые получил в 1908 году нидерландский физик Хейке Камерлинг-Оннес, удостоенный за это Нобелевской премии. При нормальных условиях Гелий - одноатомный газ без цвета и запаха. Плотность которого 0,17846 г/л, tкип -268,93°С, tпл-272,2°С. Гелий получают не из воздуха, а из природного газа: в нём содержание может достигать порядка нескольких процентов, что в тысячу раз больше чем в атмосфере. Гелий нетоксичен и не имеет вкуса. Атомная масса гелия равна 4,002602. Химические свойства. Гелий — наименее химически активный элемент восьмой группы таблицы Менделеева (инертные газы). Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2+, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором). Энергия связи молекулярного иона гелия He2+ составляет 58 ккал/моль, равновесное межъядерное расстояние 1,09 Å. Известно химическое соединение гелия LiHe (возможно, имелось в виду соединение LiHe7). Свойства в газовой фазе. При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При нормальных условиях, плотность составляет 0,17847 кг/м³, обладает теплопроводностью 0,1437 Вт⁄(м·К) — большей, чем у всех других газов за исключением водорода, а его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж⁄(кг·К), для сравнения — 14,23 кДж⁄(кг·К) для Н2). При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с большей энергией, в результате чего и происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю. Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце 19 века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. звёздный. Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм ртутного столба наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 г. Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) назван ортогелием. Линия парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения. В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно, и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2). Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом. В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49·108 с, или 7,9 года. Первые теоретические оценки показывали, что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых гелиеподобных ионов в спектрах солнечной короны было обнаружено, что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8·103 с. Следует отметить, что время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ, а для двухфотонного распада время жизни составляет 19,5 мс. Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л (15 °C), 3,2 мл/л (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода. Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера. §3 Изотопы гелия. Изотопы гелия — разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре. Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах). Гелий в атмосфере, почти весь состоящий из тяжёлого нуклида 4He, является продуктом α-распада тяжёлых радиоактивных элементов (урана, тория, актиния), лишь незначительная его часть является реликтовой (то есть захваченной миллиарды лет назад уплотнявшейся космической пылью, из которой образовалась Земля). Скорость образования гелия ничтожна и составляет около 1,16·10−7 см³ на 1 г U и 2,43·10−8 см³ на 1 г Th в год. Одна тонна связанного в минералах урана испускает за год всего 0,12 см³ гелия. Этот процесс ежегодно накапливает в доступных изучению толщах Земли и вод (25-28)·106 м³ газа. Содержание 3He в выделенном из атмосферы гелии ничтожно мало, отношение 3He/4He для воздуха равно 1,1·10−6, а для гелия из природных газов 1,4·10−7. Установлено, что 3He получается в результате β-распада тяжёлого нуклида водорода — трития, который образуется в ряде ядерных реакций в земной коре и верхних слоях атмосферы. В последних тритий возникает при обстреле азота нейтронами космического излучения: Тритий довольно быстро (T1/2=12,46 лет) распадается с образованием 3He, электронов и антинейтрино: Звёздный гелий (гелий Вселенной) — продукт термоядерной реакции синтеза ядер водорода, протекающей на Солнце и звездах по протон-протонному и углеродно-азотному циклам. Известны ещё шесть радиоактивных изотопов гелия, являющихся продуктами искусственных ядерных реакций. Так, например, нуклид 6He был получен при бомбардировке бериллия нейтронами: §4 Получение. В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий, очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Эту смесь, так называемый сырой гелий, очищают от водорода с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %). Производство Гелия мало даже в мировом масштабе. Это связано, в первую очередь, с небольшими его запасами и трудностями производства. Однако Гелий применяется сейчас во многих областях техники. §5 Применение.
Глава 2 §1 Гелий-неоновый лазер. Гелий-неоновый лазер — лазер, активной средой которого является смесь гелия и неона. Гелий-неоновые лазеры часто используются в лабораторных опытах и оптике. Имеет рабочую длину волны 632,8 нм, расположенную в красной части видимого спектра. 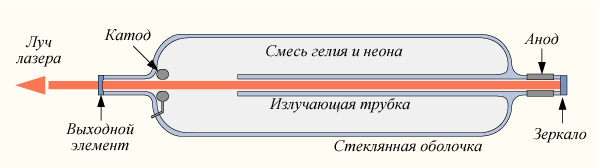 Устройство гелий-неонового лазера Рабочим телом гелий-неонового лазера служит смесь гелия и неона в пропорции 5:1, находящаяся в стеклянной колбе под низким давлением (обычно около 300 Па). Энергия накачки подаётся от двух электрических разрядников с напряжением около 1000÷5000 вольт (в зависимости от длины трубки), расположенных в торцах колбы. Резонатор такого лазера обычно состоит из двух зеркал — полностью непрозрачного с одной стороны колбы и второго, пропускающего через себя около 1 % падающего излучения на выходной стороне устройства. Гелий-неоновые лазеры компактны, типичный размер резонатора — от 15 см до 2 м, их выходная мощность варьируется от 1 до 100 мВт. Принцип действия: В газовом разряде в смеси гелия и неона образуются возбуждённые атомы обоих элементов. При этом оказывается, что энергии метастабильного уровня гелия 1S0 и излучательного уровня неона 2p55s ²[1/2] оказываются примерно равными — 20.616 и 20.661 эВ соответственно. Передача возбуждения между двумя этими состояниями происходит в следующем процессе: He* + Ne + ΔE → He + Ne* и её эффективность оказывается очень большой (где (*) показывает возбуждённое состояние, а ΔE — различие энергетических уровней двух атомов.) Недостающие 0.05 эВ берутся из кинетической энергии движения атомов. Заселённость уровня неона 2p55s ²[1/2] возрастает и в определённый момент становится больше чем у нижележащего уровня 2p53p ²[3/2]. Наступает инверсия заселённости уровней — среда становится способной к лазерной генерации. При переходе атома неона из состояния 2p55s ²[1/2] в состояние 2p53p ²[3/2] испускается излучение с длиной волны 632.816 нм. Состояние 2p53p ²[3/2] атома неона также является излучательным с малым временем жизни и поэтому это состояние быстро девозбуждается в систему уровней 2p53s а затем и в основное состояние 2p6 — либо за счёт испускания резонансного излучения (излучающие уровни системы 2p53s), либо за счёт соударения со стенками (метастабильные уровни системы 2p53s). Кроме того, при правильном выборе зеркал резонатора, можно получить лазерную генерацию и на других длинах волн: тот же уровень 2p55s ²[1/2] может перейти на 2p54p ²[1/2] с излучением фотона с длиной волны 3.39 мкм, а уровень 2p54s ²[3/2], возникающий при столкновении с другим метастабильным уровнем гелия, может перейти на 2p53p ²[3/2], испустя при этом фотон с длиной волны 1.15 мкм. Также возможно получить лазерное излучение на длинах волн 543,5 нм (зелёный), 594 нм (жёлтый) или 612 нм (оранжевый). Полоса пропускания, в которой сохраняется эффект усиления излучения рабочим телом лазера, довольно узка, и составляет около 1,5 ГГц, что объясняется наличием допплеровского смещения. Это свойство делает гелий-неоновые лазеры хорошими источниками излучения для использования в голографии, спектроскопии, а также в устройствах считывания штрих-кодов. Интересные факты
Заключение На основании всего выше сказанного можно сделать следующие выводы:
Я убеждена, что в будущем гелий будет изучен лучше, чем сейчас и станет одним из самых нужных и полезных веществ в мире. Однако своё самое обширное применение он будет иметь по-прежнему в медицине и ядерной физике. Список литературы
|