Кислоты, их классификация и свойства
 Скачать 57.63 Kb. Скачать 57.63 Kb.
|
| Гембарь Елена Васильевна Предмет: химия Класс: 8 Тема: Кислоты, их классификация и свойства Тип урока: изучение нового материала Форма урока: урок-исследование Цель урока: рассмотреть свойства кислот в свете теории электролитической диссоциации. Задачи урока: Образовательные: на основе повторения и обобщения ранее изученного материала и в ходе знакомства с новым материалом углубить знания учащихся о свойствах кислот, отработать умение составления ионных уравнений реакций. Воспитательные: формировать мировоззренческие понятия о познаваемости природы, воспитывать чувство патриотизма и уважения к своей Родине, чувство коллективизма при работе в группах, уверенность в своих силах. Развивающие: развивать познавательный интерес к предмету, память, мышление, наблюдательность в ходе эксперимента; продолжить развитие навыков работы с химическими веществами и лабораторным оборудованием в процессе выполнения лабораторного опыта. Оборудование и материалы: таблица растворимости, плакат “Химические свойства кислот”, карты-исследований, карточки-инструктажи, карточки с домашним заданием; ТСО: проектор, видеофильм “Взаимодействие оксида меди с серной кислотой”. Ход урока I. Организационный момент Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой учащихся. Создание спокойной, деловой обстановки. II. Повторение изученного материала Я хочу начать наш урок с эпиграфа: “Один опыт я ставлю выше, чем тысячу мнений, рождённых только воображением”. Это изречение принадлежит великому русскому учёному М.В.Ломоносову. Из этих слов становится ясно, какую значимость придавал он опыту. Именно поэтому Михаил Васильевич в течение 7 лет настойчиво добивался организации химической лаборатории. “Профессор химии без лаборатории никакой пользы учинить не может, точно также, как профессор астрономии без обсерватории”. В итоге первая химическая лаборатория была учреждена в России в 1748 г. В ней было выполнено большое количество исследований, было сделано много открытий. Не случайно наш урок начался со слов этого великого учёного. Сегодня мы с вами будем работать в рамках химической лаборатории, в которой, как и М.В.Ломоносов, будем проводить исследования. В нашей лаборатории мы будем изучать кислоты с точки зрения теории электролитической диссоциации. Сегодня на уроке мы рассмотрим химические свойства кислот в свете теории электролитической диссоциации. Это цель нашего урока. Тема нашего урока: “Кислоты, их классификация и свойства” (Запись даты и темы урока в тетради). Вспомним основные понятия электролитической диссоциации: – На какие группы делятся вещества по отношению к электрическому току? (Электролиты и неэлектролиты.) – Дайте определение понятию “электролит”? (Это вещество, водный раствор или расплав, которого проводит электрический ток.) – Приведите примеры электролитов? (Растворы и расплавы солей и щелочей, растворы кислот.) – Дайте определение понятию “неэлектролит”? (Это вещество, водный раствор и расплав которого не проводит электрический ток.) – Приведите примеры неэлектролитов? (Нерастворимые соли и основания, оксиды, простые вещества, органические вещества.) – Дайте определение понятию “электролитическая диссоциация”? (Это распад электролита на ионы при расплавлении или растворении в воде.) – Дайте определение кислоте из курса? (Это сложное вещество, состоящее из атомов водорода и кислотного остатка.) Существует несколько классификаций кислот. Откройте учебник на странице 157, таблица № 10 - Как могут классифицироваться кислоты? Если кислоты электролиты, то они тоже могут диссоциировать. Сейчас я вам предлагаю написать диссоциацию серной и соляной кислот. H2SO4 → 2 H+ + SO42- HСl → H+ + Cl – – Дайте определение кислоте с точки зрения теории электролитической диссоциации? (Это электролит, диссоциирующий в водном растворе на катион водорода и анион кислотного остатка.) Мы повторили основные понятия, необходимые для дальнейшего изучения химических свойств кислот. III. Изучение нового м атериала Переходим к изучению химических свойств кислот. Все химические свойства кислот представлены на плакате. На доске прикрепляю карточки (зачитываю химические свойства) 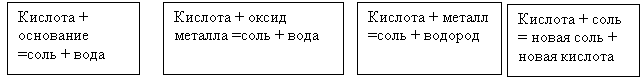 Ни одна наука не нуждается в эксперименте в такой степени как химия. Ее основные законы, теории и выводы опираются на факты, поэтому постоянный контроль опытом необходим”. Поэтому опытным путем докажем химические свойства кислот, соблюдая технику безопасности. Инструкция “Меры безопасности при работе с кислотами”, инструкция проведения опыта), учащиеся разделены на 4 группы. Перед выполнением лабораторного опыта, учащиеся читают инструкцию. “Взаимодействие кислот с щелочами (основаниями)” Порядок выполнения работы: В пробирку налейте 2 мл раствора гидроксида натрия и прибавьте 1-2 капли фенолфталеина. Что вы наблюдаете? К раствору щелочи с фенолфталеином приливайте по каплям соляную кислоту, периодически взбалтывая содержимое пробирки. Что вы наблюдаете? Составьте молекулярное и ионные уравнения проделанной реакции. Лабораторный опыт “ Взаимодействие кислот с солями”. Порядок выполнения работы: В пробирку налейте 2 мл серной кислоты и прибавьте несколько капель хлорида бария. Что вы наблюдаете? Напишите молекулярное и ионные уравнения проделанной реакции Лабораторный опыт “Взаимодействие кислот с металлами” Порядок выполнения работы: В пробирку положите 2 гранулы цинка и прилейте соляную кислоту, закройте пробирку пробкой. Подождите некоторое время, чтобы она заполнилась водородом, затем откройте пробку и поднесите зажженную спичку к отверстию. Что вы наблюдаете? Напишите молекулярное уравнение проделанной реакции. Лабораторный опыт “Взаимодействие кислот с основными оксидами” (видеофрагмент) После выполнения работы 4 учащихся от каждой группы выходят к доске и пишут уравнения реакции под соответствующими карточками. В это время 4 других учащихся представляют отчет о проделанной работе. Затем зачитываю применение кислот в быту. Уксусная и лимонная кислота применяется для удаления пятен от ржавчины на хлопчатобумажных, льняных и шерстяных белых тканях. 1 чайная ложка на 1 стакан воды, подогреть до кипения и ткань с пятном несколько раз окунуть в раствор или пятно протереть раствором, а затем кислоту тщательно смыть водой, лучше с добавлением несколько капель нашатырного спирта – для нейтрализации кислоты. IV. Закрепление Задание: составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева. 1) SiО2 А 2) LiОН К 3) Ва NО3 А 4) НСI С 5) К2О Л 6) К2 SiО3 И 7) Н NО3 О 8) Fе(ОН)3 Й III. Подведение итогов урока Подведем итоги урока. Сегодня в рамках химической лаборатории мы исследовали кислоты с точки зрения теории электролитической диссоциации. Давайте ещё раз обратимся к эпиграфу, с которого мы начали наш урок: “Один опыт я ставлю выше, чем тысячу мнений рождённых только воображением”. Этим мудрым высказыванием М.В. Ломоносова давайте завершим наш урок. IV. Домашнее задание Учащиеся получают необычное домашнее задание разного уровня сложности “Кем вы считаете себя в химии?”: кандидатом наук, профессором или академиком. Ученые степени расположены в порядке возрастания от кандидата наук до академика. Самая высшая учёная степень – академик. Дома ученики выбирают посильный для себя вариант работы с той учёной степенью, на которую они претендуют. Каждый вариант работы включает 2 задания, одно из них носит творческий характер. К следующему уроку выполняется первое задание, на выполнение второго задания даётся одна неделя. |