Пояснительная записка
 Скачать 430.85 Kb. Скачать 430.85 Kb.
|
1 2
| ЧАСТЬ А. Тестовые задания с выбором ответа и на соответствие 1. Характеристика реакции, уравнение которой 4Fe + 6H2O + 3O2 = 4Fe(OH)3: А. Соединения, ОВР, обратимая. Б. Замещения, ОВР, необратимая. В. Соединения, ОВР, необратимая. Г. Обмена, не ОВР, необратимая. 2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С + О2 = СО2 + 402 кДж, если при этом выделяется 1608 кДж теплоты? А. 4,8 г. Б. 48 г. В. 120 г. Г. 240 г. 3. Характеристика реакции, уравнение которой 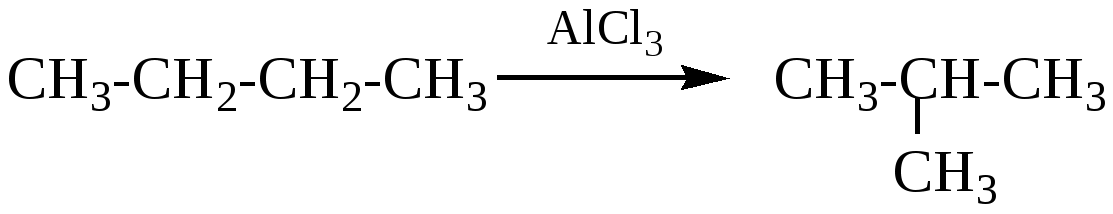 А. Дегидрирования, гомогенная, каталитическая. Б. Изомеризации, гомогенная, каталитическая. В. Полимеризация, гетерогенная, каталитическая. Г. Присоединения, гетерогенная, каталитическая. 4. Окислитель в реакции синтеза аммиака, уравнение которой N2 + 3H2 ↔ 2NH3 + Q: А. N0. Б. Н0. В. Н+1. Г. N-3. 5. При повышении температуры на 30 ˚С (температурный коэффициент γ = 3) скорость реакции увеличится: А. В 3 раза. В. В 27 раз. Б. В 9 раз. Г. В 81 раз. 6. Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой СаО + СО2 ↔ СаСО3 + Q, в сторону образования продукта реакции: А. Повышения температуры и давления. Б. Понижение температуры и давления. В. Понижение температуры и повышение давления. Г. Повышение температуры и понижение давления. ЧАСТЬ Б. Задания со свободным ответом 7. Составьте уравнение реакции горения водорода. Дайте полную характеристику данной химической реакции по всем изученным классификационным признакам. 8. В какую сторону сместится химическое равновесие в реакции, уравнение которой в случае: А. Повышения давления? Б. Уменьшения температуры? В. Увеличения концентрации С2H4? Г. Применение катализатора? Дайте обоснованный ответ. 9. Чему равна скорость химической реакции Mg + 2HCl = MgCl2 + H2 при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль/л? Вариант 2 ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение 1. Характеристика реакции, уравнение которой 2 КClО3 = 2КCl + 3O2 ↑: А. Реакция замещения, ОВР, обратимая. Б. Реакция разложения, ОВР, необратимая. В. Реакция разложения , не ОВР, необратимая. Г. Реакция обмена, не ОВР, необратимая. 2. Какое количество теплоты выделяется при взаимодействии 5,6 л водорода (н.у.) с избытком хлора (термохимическое уравнение: H2 + Cl2 = 2НCl + 92,3 кДж)? А. 2,3 кДж. Б. 23кДж. В. 46 кДж. Г. 230 кДж. 3. Характеристика реакции, уравнение которой А. Дегидрирования, гомогенная, каталитическая. Б. Гидратации, гомогенная, каталитическая. В. Гидрирования, гетерогенная, каталитическая. Г. Дегидратации, каталитическая, гомогенная. 4. Восстановитель в реакции , уравнение которой 2СО +О2 = ↔ 2СО2 + Q: А. С+2. Б. С+4. В. О0. Г. О-2. 5. Для увеличения скорости химической реакции в 64 раза (температурный коэффициент γ = 2) надо повысить температуру: А. На 30 ˚С. В. На 50 ˚С. Б. На 40 ˚С. Г. На 60 ˚С. 6. Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой 2NO + О2 ↔ 2NO2 + Q, в сторону образования продукта реакции: А. Повышения температуры и давления. Б. Понижение температуры и давления. В. Понижение температуры и повышение давления. Г. Повышение температуры и понижение давления. ЧАСТЬ Б. Задания со свободным ответом 7. Составьте уравнение реакции взаимодействия магния с соляной кислотой. Дайте полную характеристику данной реакции по всем изученным признакам. 8. В какую сторону сместится химическое равновесие реакции, уравнение которой В случае: А. Повышения температуры? Б. Уменьшения давления? В. Увеличения концентрации O2? Г. Применение катализатора? Дайте обоснованный ответ. 9. Чему равна скорость химической реакции, уравнение которой CuO + H2SO4 = CuSO4 + H2O при уменьшение концентрации кислоты за каждые 10 с на 0,03 моль/л? Практические работы: Практическая работа №1 «Получение, собирание и распознавание газов». Цель работы: Научиться получать, собирать и распознавать газы. Проводить опыты, характеризующие свойства данного газа. Вариант - 1 1. Получение, собирание и распознавание водорода. В пробирку поместите две гранулы и прилейте в нее 1 – 2 мл соляной кислоты. Что наблюдаете? Напишите уравнение реакции. Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1 – 2 минуты поднимите большую пробирку вверх и, не переворачивая ее, поднесите к пламени спиртовки. Что наблюдается? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую пробирку? 2. Получение, собирание и распознавание аммиака. В пробирку прилейте 1 – 2 мл раствора хлорида аммония, а затем такой же объем раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдается? Запишите уравнение реакции в молекулярной и ионной формах. Поднесите к отверстию пробирки влажную универсальную индикаторную бумажку. Что наблюдается? Осторожно понюхайте выделяющийся газ. Что ощущаете? Вариант – 2 1. Получение, собирание и распознавание кислорода. В пробирку объемом 20 мл прилейте 5 – 7 мл раствора пероксида водорода. Подготовьте тлеющую лучинку (подожгите ее и, когда она загорится, взмахами руки погасите). Поднесите к пробирке с пероксидом водорода, куда предварительно насыпьте немного (на кончике шпателя) оксида марганца (IV). Что наблюдаете? Запишите уравнение реакции. 2. Получение, собирание и распознавание углекислого газа. В пробирку объемом 20 мл поместите кусочек мрамора и прилейте раствор уксусной кислоты. Что наблюдаете? Через 1 – 2 минуты внесите в верхнюю часть пробирки горящую лучину. Что наблюдается? Запишите уравнение реакции в молекулярной и ионной формах. В пробирку налейте 1 – 2 мл прозрачного раствора известковой воды. Используя чистую стеклянную трубочку, осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах. Практическая работа №2 «Идентификация неорганических соединений». Цель работы: Определение качественного состава неорганических веществ, распознавание выданных веществ с помощью качественных реакций. 1. В трех пробирках даны водные растворы следующих веществ: сульфида натрия, хлорида железа (III) и серной кислоты. Опытным путем определите, какие вещества находятся в каждой из пробирок. Составьте уравнения соответствующих реакций в молекулярном, полном и сокращенном ионном виде. Результаты работы оформите в виде таблицы:
Уравнения соответствующих реакций: Вариант - 2 1. В трех пробирках даны водные растворы следующих веществ: сульфата калия, хлорида аммония и карбоната натрия. Опытным путем определите, какие вещества находятся в каждой из пробирок. Составьте уравнения соответствующих реакций в молекулярном, полном и сокращенном ионном виде. Результаты работы оформите в виде таблицы:
Уравнения соответствующих реакций: |
1 2