Урок 25 по теме: "Химические свойства водорода. Применение водорода"
 Скачать 44.78 Kb. Скачать 44.78 Kb.
|
| Урок 25 по теме: "Химические свойства водорода. Применение водорода" Цель урока. Изучить химические свойства водорода. Сформировать представления о водороде как о восстановителе и экологически чистом топливе. Основные понятия. Гремучий газ, восстановитель, восстановление, экологически чистое топливо. Планируемые результаты обучения. Уметь составлять уравнения реакций водорода с кислородом и с оксидами металлов. Демонстрация. Взрыв смеси водорода с воздухом. Лабораторный опыт. Взаимодействие водорода с оксидом меди(II). Демонстрации. Горение углерода, серы, фосфора, железа в кислороде. Ход урока
Химические свойства водорода При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Водород вступает в реакции с простыми и сложными веществами: 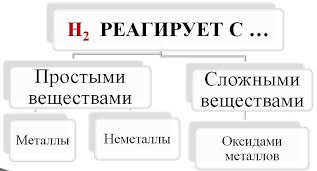 - Взаимодействие водорода с металлами приводит к образованию сложных веществ - гидридов, в химических формулах которых атом металла всегда стоит на первом месте: 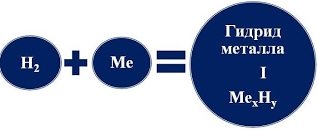 При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества - гидриды металлов (LiН, NaН, КН, СаН2 и др.): Н2 + 2Li = 2LiH Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода: СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑ - При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде): 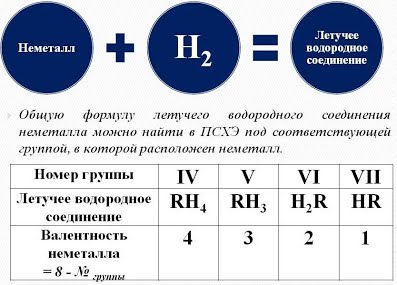 1). С кислородом Водород образует воду: Видео "Горение водорода" 2Н2 + О2 = 2Н2О + Q При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом (смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом). Видео "Взрыв гремучего газа" Видео "Приготовление и взрыв гремучей смеси" 2). С галогенами Водород образует галогеноводороды, например: Н2 + Cl2 = 2НСl При этом с фтором Водород взрывается (даже в темноте и при - 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с йодом только при нагревании. 3). С азотом Водород взаимодействует с образованием аммиака: ЗН2 + N2 = 2NН3 лишь на катализаторе и при повышенных температуpax и давлениях. 4). При нагревании Водород энергично реагирует с серой: Н2 + S = H2S (сероводород), значительно труднее с селеном и теллуром. 5). С чистым углеродом Водород может реагировать без катализатора только при высоких температуpax: 2Н2 + С (аморфный) = СН4 (метан) - Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород - проявляет свойства восстановителя: 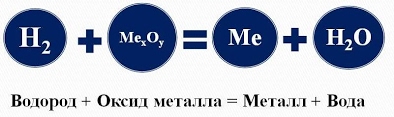 Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов: CuO + H2 = Cu + H2O, Fe3O4 + 4H2 = 3Fe + 4Н2О, и т. д.
Задание №1 Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций. Задание №2 Осуществите превращения по схеме: H2O -> H2 -> H2S -> SO2 Задание №3. Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Применение водорода Видео "Применение водорода" В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород". Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.). Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т. Домашнее задание. § 20, 21, упр. 4—12, задачи 2, 3 (с. 60); повторить способы получения и собирания кислорода. | ||||||||||||||||||||||||||||||||||