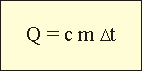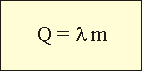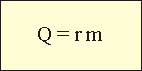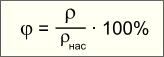«Программа работы физического кружка»
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
Физические свойства водыПод свойствами воды понимают совокупность биохимических, органолептических, физико-химических, физических, химических и других свойств воды. Многие свойства воды аномальны, это вызвано особенностями строения молекулы воды. Вода (Н2О)– это окись водорода, она является наиболее важным и распространенным веществом, в природе не существует чистой воды, в ней обязательно содержатся какие-либо примеси, чистая вода не имеет вкуса и запаха, прозрачна, ее получают в процессе перегонки, после этого она называется дистиллированная. При переходе воды из твердого состояния в жидкое ее плотность не уменьшается, а возрастает, также плотность воды увеличивается при ее нагреве от 0 до 4°С, максимальную плотность вода имеет при 4°С, и только при последующем ее нагревании плотность уменьшается. Еще одним свойством воды является то, что она обладает высокой теплоемкостью (4,1868 кДж/кг), это объясняет, почему в ночное время и при переходе от лета к зиме вода остывает медленно, а днем или во время перехода от зимы к лету так же медленно нагревается, благодаря этому свойству вода является регулятором температуре на Земле. Среди всех жидкостей вода имеет самое высокое поверхностное натяжение, исключение составляет только ртуть. Дистиллированная вода не проводит электрический ток, так как она слабый электролит и диссоциирует в малой степени. По массе в состав воды входит 88,81% кислорода и 11,19% водорода, а наибольшую плотность вода имеет при 0°С (1г/см3), она плохой проводник для электричества и теплоты, но хороший растворитель, вода кипит при температуре 100°С, а замерзает при 0°С. Тяжелой водой (D2О) называется та вода, в состав которой входит изотоп водорода дейтерий, химические реакции с такой водой протекают медленнее, чем с обычной. Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.
Интересное о воде
Количество теплоты и калориметрРассмотрим конкретный пример измерения количества теплоты. Во внутренний стакан калориметра нальем 100 г воды. Измерим ее температуру: 20 °С. Погрузим в воду какое-нибудь горячее тело, например, стальной цилиндрик. В калориметре начнется теплообмен, и некоторое количество теплоты перейдет от цилиндрика к воде. В результате ее температура повысится. Вычислим изменение температуры: ∆t вод = 60 °С – 20 °С = 40 °С. Зная, что масса воды была 100 г, инженер-теплотехник скажет: вода получила 100 · 40 = 4000 калорий теплоты. В отличие от инженеров-теплотехников, ученые-физики количество теплоты измеряют джоулями. Для этого применяется специальная формула:
По формуле легко подсчитать, что вода, находящаяся внутри калориметра, получила от цилиндрика 16,8 кДж теплоты:
Примечание: калория – устаревшая единица измерения количества теплоты. Она определяется как энергия, необходимая для нагревания 1 г воды на 1°С.
Коэффициент "λ" берут из таблиц. Точные калориметрические измерения показывают, что при кристаллизации вещества выделяется такое же количество теплоты, которое было затрачено на образование расплава. Подсчет теплоты, необходимой для парообразования. Очевидно, что масса образовавшегося пара всегда равна массе выкипевшей жидкости. Зная ее, легко подсчитать количество теплоты, затраченное на образование пара. Для этого служит следующая формула.
Коэффициент "r" берут из таблиц. Точные калориметрические измерения показывают, что при конденсации вещества выделяется такое же количество теплоты, которое было затрачено на образование пара. Плавление и кристаллизация Весна. Выглянуло солнышко, и сквозь осевшие сугробы и журчащие ручьи пробиваются первые подснежники. Но взгляните на рисунок: температура и снега, и талой воды остается 0 °С. Так будет до тех пор, пока не растает последний кристаллик льда, даже если температура воздуха станет +10 °С!
В физике превращение кристаллического тела в жидкость называют плавлением. Поэтому превращение снега (а он состоит из мельчайших кристалликов льда) в воду – это также плавление. Многочисленные наблюдения за плавлением разных тел показывают, что каждое кристаллическое тело плавится при строго определенной температуре; во время плавления температура тела и образующейся жидкости одинакова и остается постоянной до тех пор, пока все тело не расплавится. Температуры плавления/ кристаллизации,°С
Если расплавленное вещество охлаждать, то вскоре наступит его кристаллизация – образование кристаллов твердого вещества. Но температура жидкого и твердого веществ во время этого будет оставаться постоянной и равной температуре плавления, пока вся жидкость не отвердеет. Кипение и конденсация Нальем в сосуд чистой воды и поместим над горелкой. Вскоре на дне и стенках сосуда мы заметим многочисленные пузырьки. Они содержат водяной пар и воздух, который всегда растворен в воде.
Шум создается растущими и захлопывающимися пузырьками. Постепенно вода прогревается, и давление пара внутри пузырьков уже не уменьшается. Пузырьки перестают захлопываться и начинают расти. С этого момента шум становится тише. По мере увеличения объема пузырьков возрастает архимедова сила, и они начинают всплывать.
Опыты показывают, что во время кипения температура жидкости и пара над ее поверхностью одинакова и остается постоянной до полного выкипания жидкости. Температуры кипения, °С (при ратм=101,3 кПа)
К 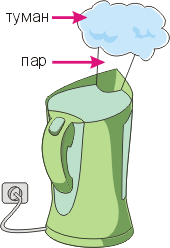 онденсация. онденсация.Этим термином в физике называют превращение вещества из газообразного состояния в жидкое. Взгляните на рисунок: пар, вырывающийся из чайника невидимой струей, вскоре конденсируется – превращается в туман (скопление мельчайших капелек воды). Чтобы конденсация произошла, пар должен отдать теплоту окружающим телам. В результате он превратится в жидкость или туман, а окружающие его тела нагреются. Например, при конденсации всего пара, вырывающегося из носика кипящего чайника, выделяется столько теплоты, что ее хватит для нагревания двух ведер воды комнатной температуры до 100 °С! Влажность воздуха. Для хорошего самочувствия человека и нормального хода многих технологических процессов совершенно небезразлично, насколько водяной пар, содержащийся в воздухе, далек от насыщения. Если в воздухе содержится мало водяных паров, то это создает чувство сухости во рту, одежда "электризуется" и липнет к телу. Если же пар, содержащийся в воздухе, наоборот, почти насыщен, то при малейшем понижении температуры наступит конденсация пара, и все предметы покроются капельками влаги (росы). Следовательно, нужно ввести какую-либо физическую величину, характеризующую влажность воздуха. Она должна показывать, насколько пар, содержащийся в воздухе, далек от насыщения. Такую величину называют относительной влажностью воздуха:
Относительная влажность воздуха показывает выраженную в процентах долю, которую составляет плотность пара, содержащегося в данный момент в воздухе, от плотности насыщенного пара для этой же температуры.
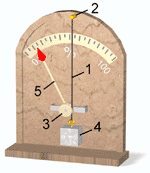
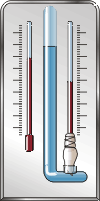
Психрометр Августа имеет два термометра: "сухой" и "влажный". Они так называются потому, что конец одного из термометров находится в воздухе, а конец второго обвязан кусочком марли, погруженным в воду (см. рисунок). Испарение воды с поверхности влажного термометра приводит к понижению его температуры. Второй же, сухой термометр, показывает обычную температуру воздуха. Измеренные психрометром значения температур можно перевести в значение относительной влажности воздуха по специальной таблице.
|