Решение задач по уравнениям химических реакций с использованием логических схем
 Скачать 78.05 Kb. Скачать 78.05 Kb.
|
                  Учебно – методическое пособие по химии (8-9 класс) на тему: Учебно – методическое пособие по химии (8-9 класс) на тему:Решение задач по уравнениям химических реакций с использованием логических схем. Автор: Руснак А.П. ГБОУ школа № 181 Центрального района Санкт - Петербурга Решить задачу, как в жизни, так и на уроках химии – достаточно непросто. Необходимо разобраться в сущности этой задачи, проанализировать её, составить план решения задачи, выполнить определённые действия и получить желаемый результат. Решение задачи – это маленькое исследование, которое требует и химической логики и не всегда стандартного решения. Каждый раз надо спрашивать, почему я поступил именно так, а не иначе? Решение задач на уроках химии способствует развитию как предметных так метапредметных действий: Регулятивные УУД 1.самостоятельно обнаруживать и формулировать учебную проблему, определять цель учебной деятельности 2.выдвигать версии решения проблемы, выбирать из предложенных и искать самостоятельно средства достижения цели 3.составлять (индивидуально или в группе) план решения проблемы Познавательные УУД 1.анализировать 2.строить логическое рассуждение 3.преобразовывать информацию из одного вида в другой Все задачи, решаемые с использованием уравнений химических реакций, основываются на основе закона сохранения массы веществ: масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. Схема решения задач: Условие задачи → Запись уравнения → Расчеты по уравнению→ Ответ ХР ХР Порядок решения задач:
6.Запись ответа задачи В решении задачи выделяют две части: химическую и математическую. Химическая часть задачи включает действия: чтение текста; запись условия задачи; исследование задачи – определение типа задачи; анализ задачи – составление плана решения. Математическая часть задачи включает действия: выбор способа решения; решение (расчеты); запись ответа; анализ (проверка) решения; Образец решения задачи: Задача: Вычислите количества вещества и массу оксида меди, полученного при окислении 6,4 г. меди. Дано: Решение m(Cu) = 6,4 г Составим схему решения задачи: Найти:m(CuO)-? n (CuO)-? m(Cu) → n (Cu) → n(CuO) → m(CuO) ∕ ∕ M(Cu) M(CuO)
0,1 моль n 2Cu + O2 = 2CuO n = 2моль n = 2 моль или n(CuO)=n(Cu)=0,1 моль. 2) 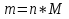 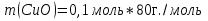 =8г. =8г.Ответ: 8 г CuO;0,1моль CuO. Задача: По уравнению реакции KClO3→KCl+O2 рассчитай количество вещества и массу KClO3 , необходимое для получения кислорода объёмом 67,2 литра. Дано: Решение V(O2 ) = 67,2л Составим схему решения задачи: Найти:m(KClO3), n (KClO3)-? V(O2) → n (O2) → n(KClO3) → m(KClO3) ∕ ∕ Vm=22,4 л/моль M(KClO3) 1) 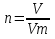 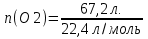 =3 моль =3 мольn 3моль 2 KClO3 → 2KCl+3O2 n = 2моль n = 3 моль 2)или n(KClO3)= 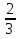 n (O2)= n (O2)=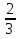 *3моль=2моль *3моль=2моль3) M=39+35,5+3*16=122,5 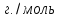 4) 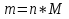  =245г. =245г.Ответ: 245 г KClO3;2 моль KClO3. Вычисления по химическим уравнениям, если одно из исходных веществ содержит примеси. Абсолютно чистого вещества в природе не бывает, поэтому в химических производствах вынуждены использовать исходные вещества, содержащие примеси. Содержание примеси обычно выражают в долях от единицы (или выражают в %). Для вычисления массы основного вещества, содержащегося в смеси, используют формулу 2. 1) 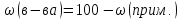 (1) (1) 2) 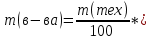 ω(в-ва) (2) ω(в-ва) (2)3)m(технич.) = m(осн.в.) + m(прим.) (3) Решение задачи следует начать с расчета массовой доли основного вещества. Далее необходимо определить его массу и количество вещества. Записать уравнение нужной реакции со всеми коэффициентами. По уравнению реакции определить количество вещества Далее рассчитываются масса или объем требуемого вещества. Задача: Какой объем углекислого газа (н. у) выделится при прокаливании 5 кг. известняка, в котором массовая доля некарбонатных примесей равна 20%. Дано: Решение задачи: mтех(CaCO3) = 5кг. ω (примесей) =20% Составим схему решения задачи : _________________ Найти:V (CO2)-? mтех(CaCO3) → m (CaCO3) → n(CaCO3) → n(CO2) → V(CO2) ∕ ∕ ↑ M(CaCO3) Vm=22,4 л/моль ω (примесей) → ω(CaCO3) 1) 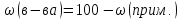 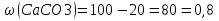 2) 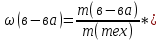 100% 100%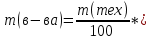 ω(в-ва) ω(в-ва)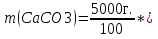 80%=4000г. M=40+12+3*16=100 80%=4000г. M=40+12+3*16=100 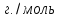 3) 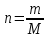 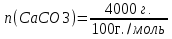 =40 моль =40 моль4) Запишем уравнение реакции и найдем n(CO2): CaCO3 → CaO + CO2 n(CO2)=n(CaCO3) = 40 моль. 5) 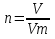 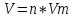 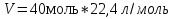 =896 л. =896 л. Ответ: 896 л. CO2. Вычисления по химическим уравнениям, если одно из исходных веществ дано в избытке. Если в условии задачи есть числовые данные (массы или объемы) по обоим веществам, участвующим в реакции, то, возможно, одно из них находится в избытке. Поэтому решение задачи следует начать с расчета количеств этих веществ. Далее необходимо записать уравнение нужной реакции со всеми коэффициентами. По коэффициентам в уравнении и найденным количествам веществ, следует определить, какое из веществ находится в избытке, а какое – в недостатке. В уравнении реакции над формулой вещества, находящегося в недостатке, записываем его количество и с учетом коэффициентов находим количества остальных веществ, участвующих в реакции. Далее рассчитываются массы или объемы остальных веществ. Задача: К раствору, содержащему соляную кислоту массой 36,5 г. прибавили оксид меди (II) массой 8 г. Вычисли количества вещества полученной соли. Д а н о: Решение задачи: m (HСl)=36,5г Составим схему решения задачи: m (CuO) = 8г n(CuCl2)-? m (HСl) n (HСl) M (HСl) n (CuCl2)-? m (CuO) n (CuO) M (CuO) CuO+ 2HСl = CuCl2+ H2 O 1 моль 2 моль М(HCl) = 36,5г/моль; n(HCl) =36,5г: 36,5г/моль = 0,1 моль М(CuO) = 80г/моль; n(CuO) = 8 г: 80г/моль = 0,1 моль 0,1моль 0,1моль x CuO + 2 HCl = CuCl2 + H2 O 2) 1 моль 2 моль 1моль 0,1 > 0,1 1 2 Вещество CuO– в избытке, расчёт по веществу HCl. 3) n(CuСl2)= 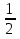 * n(HCl)= 0,05 моль. * n(HCl)= 0,05 моль. Ответ: 0,05 моль CuСl2. |
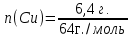 =0,1 моль
=0,1 моль