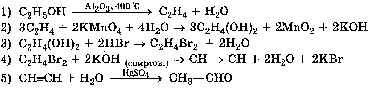Третья часть теста 5 заданий части С, включает в себя задания повышенной сложности. Каждое задание данной части индивидуально и нестандартно. В задании С1
 Скачать 302.05 Kb. Скачать 302.05 Kb.
|
    ХИМИЯ Каждый сдающий ЕГЭ по химии должен быть готов к тому, что на выполнение экзаменационной рабо ты, состоящей из трех частей и включающей в себя 45 заданий, отводится 3 астрономических часа, или 180 минут. В официальных документах данное время рекомендуется распределить так: каждое задание части А – 2-3 минуты; каждое задание части В – до 5 минут; каждое задание части С – до 10 минут. Однако учителю следует рекомендовать учащимся экономить время на относительно легких частях А и В для того, чтобы использовать больший резерв времени при выполнении части С, которая является самой сложной, а, значит, и самой «дорогой» в балльном отношении. Часть С (С1-С5) включает 5 заданий высокого уровня с развернутым ответом. Задания с развернутым ответом предусматривают одновременную проверку усвоения нескольких элементов содержания из различных содержательных блоков. В экзаменационной работе 2009г. представлены следующие типы заданий с развернутым ответом: задания, проверяющие усвоении темы окислительно-восстановительные реакции; задания, проверяющие знания химических свойств неорганических веществ; задания, проверяющие усвоение учебной информации о взаимосвязи различных классов веществ (органических и неорганических); комбинированные расчетные задачи; задачи на определение молекулярной формулы вещества. Третья часть теста - 5 заданий части С, - включает в себя задания повышенной сложности. Каждое задание данной части индивидуально и нестандартно. В задании С1 предлагается, используя метод электронного баланса, составить уравнение какой-либо окислительно-восстановительной реакции и определить окислитель и восстановитель. Задания С1 можно условно разделить на три типа: 1) пропущены формулы каких-либо веществ в правой части уравнения Пример: P + HNO3 → NO2 + … KMnO4 + H2S + H2SO4 → MnSO4 + S + … + … K2Cr2O7 + HCl → Cl2 + KCl + … + … 2) пропущены формулы каких-либо веществ в левой его части Пример: KMnO4 + KBr + … → MnSO4 + Br2 + K2SO4 + H2O Р2O3 + H2Cr2O7 + … → H3PO4 + CrPO4 3) формулы веществ пропущены в обеих частях уравнения Пример: Сr2(SO4)3 + … + NaOH → Na2CrO4 + NaBr + … + H2O Максимальный балл за это задание – 3 балла (1-ый балл ставится за написание баланса, 2-й – за написание уравнения, 3 - за определение окислителя и восстановителя). В задании С2 даны четыре или пять веществ, между которыми нужно написать четыре уравнения реакций, причем при этом необходимо использовать все указанные в задании вещества. Пример:
Данное задание является, пожалуй, самым сложным из всех заданий теста ЕГЭ и проверяет знания химических свойств неорганических веществ. Максимальный балл в данном задании – 4 балла (по 1 баллу ставится за каждое верно написанное уравнение реакции). В задании С3 необходимо осуществить цепочку из пяти превращений между органическими веществами, в которой пропущено несколько звеньев. Пример: +Zn +HBr t° +KMnO4
H2O + H2O t° KMnO4 + H2O
Максимальный балл в данном задании – 5 баллов (по 1 баллу ставится за каждое верно написанное уравнение реакции). В задании С4 необходимо рассчитать массу (объем, количество вещества) продуктов реакции, если одно из веществ дано в избытке и указано в задании в виде раствора с определенной массовой долей растворенного вещества или содержит примеси. Максимальный балл за верное выполнение данного задания – 4 балла (баллы ставятся за каждое промежуточное действие). Пример:
В задании С5 необходимо определить молекулярную формулу вещества. Максимальный балл 2 (баллы ставятся за каждое промежуточное действие). Пример:
Таким образом, за верное выполнение части С можно набрать 18 баллов (чуть более 27 % от максимально возможного). Максимально возможное число первичных баллов за тест ЕГЭ по химии 2009 г равно 66. Анализ выполнения заданий Части С В 2009 году процент выпускников, приступивших к выполнению части С теста ЕГЭ по химии составил 90,2 %. Обобщенные результаты выполнения заданий части С представлены в таблице 1. Таблица 1 Результаты выполнения заданий высокого уровня (часть С) экзаменационной работы ЕГЭ 2009 г
Средний показатель выполнения заданий части С в 2009 г. составил 36.94 %, Типичные ошибки при выполнении задания С1: неумение определить вещество, определяющее среду раствора окислительно-восстанови-тельной реакции (например, воду); неумение выбрать окислитель и восстановитель среди соединений с переменной степенью окисления (например, при взаимодействии нитрита калия и перманганата калия); неумение предсказать продукты восстановления типичных окислителей (перманганата калия, йода, нитрита калия) и продукты окисления восстановителей (диоксид марганца) в различных средах, а также возможность участия молекул воды в этих процессах; неумение предсказать окислительные (восстановительные) свойства элементов с промежуточной степенью окисления в конкретных процессах (например, элемента хрома в оксиде хрома (III)). Это можно объяснить тем, что указанные темы детально изучаются только в профильном курсе химии. В базовом курсе эти вопросы рассматриваются в ознакомительном плане. Задания С2 проверяли знание свойств и генетическую взаимосвязь основных классов неорганических соединений. С заданием С2, в основном, справилось менее трети выпускников, что можно объяснить сложностью задания. Типичными затруднениями при выполнении этого задания было: неумение проанализировать возможность взаимодействия веществ (простых и сложных) с позиций принадлежности их к определенным классам неорганических соединений, а также с позиций возможности протекания окислительно-восстановительных реакций; незнание специфических свойств галогенов, фосфора и их соединений, кислот - окислителей, амфотерных оксидов и гидроксидов, восстановительных свойств сульфидов и галогенидов. Задание С3 выполнило менее четверти выпускников. Это объясняется усложнением заданий данного типа. Типичные ошибки при выполнении задания С3: незнание условий протекания химических реакций, генетической связи классов органических соединений; незнание механизмов, сущности и условий реакций c участием органических веществ, свойств и формул органических соединений; неумение предсказать свойства органического соединения на основе представлений о взаимном влиянии атомов в молекуле; незнание окислительно-восстановительных реакций (например, с перманганатом калия). Заданием С4 была комбинированная расчетная задача. С заданием справилось более трети выпускников. В условиях задач этого вида комбинировались следующие действия: расчеты по уравнению, когда одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества; вычисления, когда одно из реагирующих веществ дано в избытке; определение массы растворенного вещества в растворе; расчеты по уравнениям последовательно протекающих реакций. Наиболее часто учащимися допускаются ошибки: при определении массы раствора без учета массы выделившегося газа или осадка; при определении массовой доли растворенного вещества в растворе, полученного при смешивании растворов с различной массовой долей растворенного вещества; при определении количества веществ, вступающих в реакцию. Задания С5 – нахождение молекулярной формулы вещества по данным качественного и количественного анализа. Задачу решили более половины выпускников. Многие учащиеся смогли правильно выполнить первое действие – найти простейшее отношение молей атомов в соединении, но не смогли перейти к определению истинной формулы. Затруднение вызвала задача, предполагающая определение молекулярной формулы, если известны продукты горения – объем углекислого газа и массы азота и воды. Ознакомление выпускников с технологией оценивания заданий Части С Задания части С проверяют опытные учителя-эксперты, в отличии от частей А и В, которые проверяются с помощью компьютера. Поэтому важно при оформлении ответов по заданиям части С, по возможности, не использовать сокращения в словах и максимально полно записывать решение задач. Можно выполнять решение любого задания части С с любого звена, каждое из которых имеет свою цену в 1 балл. В этом случае выпускники наберут какое-то количество баллов из максимально предусмотренного тестом за полное и правильное выполнение задания. Например, почти каждый экзаменующийся сможет определить в задании С1 окислитель и восстановитель или записать уравнение реакции для задачи С4, тем самым обеспечив себе по 1 баллу за каждое действие. Другими словами, необходимо выполнять все фрагменты, которые они могут выполнить по каждому заданию части С. Учителю необходимо довести до сведения учащихся, что при разработке критериев оценивания учитываются особенности проверки усвоения элементов содержания всех пяти заданий с развернутым ответом, включаемых в экзаменационную работу. Принимается во внимание и тот факт, что формулировки ответов экзаменующихся могут быть как очень общими, обтекаемыми и не конкретными, так и излишне краткими и не достаточно аргументированными. Пристальное внимание уделяется также распределению самого текста оригинала ответа по равнозначным элементам содержания, оцениваемым в один балл. При этом учитывается неизбежность постепенного повышения трудности получения каждого последующего балла за правильно сформулированный элемент содержания. Так, при составлении шкалы оценивания расчетных задач учитывается многовариантность путей их решения, а, следовательно, присутствие в ответе основных его этапов и результатов, указанных в критериях оценивания. Общей особенностью оценивания всех заданий с развернутым ответом, подчеркивает учитель, признана необходимость фиксации в ответах условий осуществления данной химической реакции. Проиллюстрируем сказанное на примерах оценивания отдельных видов заданий с развернутым ответом, использованных в КИМах ЕГЭ. Задание. Используя метод электронного баланса, составьте уравнение реакции: SO2 + K2Cr2O7 + … → K2SO4 + …+ H2O Определите окислитель и восстановитель.
Проиллюстрируем на примере оригинала работы выпускника оценивание ее экспертами.
Будет полезным, если учитель попросит учащихся выполнить аналогичное задание, а затем оценить это выполнение в соответствии с предложенными критериями оценивания. Например. Используя метод электронного баланса, составьте уравнение реакции: P + HNO3 +… → NO +… Определите окислитель и восстановитель.
При отработке этого этапа подготовки выпускников к ЕГЭ -2010 можно использовать оригинал одной из работ выпускников школ Подмосковья.
Нетрудно заметить, что эта работа заслуживает только 1 балла, так как, несмотря на составление электронного баланса, в нем отсутствует указание на то, какой элемент (вещество) является окислителем и какой – восстановителем. Также выпускник в своей работе не расставил коэффициенты в уравнении реакции. Типичные ошибки части С (2006-2007 г) Задание С1. Типичные ошибки: при определении возможных продуктов не учитывается среда реакции, исходные вещества. Например: P + HNO3 →P2O5 + … - азотная кислота, даже концентрированная всегда содержит воду, оксид фосфора энергично взаимодействует с водой – может ли он образоваться в водной среде? Конечно нет, правильный продукт – H3PO4. K2Cr2O7 + … H2SO4 → … + Cr(OH)3 + … - гидроксид хрома(III) – основание, пусть и амфотерное, может ли оно получиться в кислой среде? Или оксид Cr2O3? Конечно нет, правильный продукт – Cr2(SO4)3. Обидная ошибка – все как будто правильно, а окислитель-восстановитель не указан, в результате теряется балл. Или написаны буковки “о”-“в”, и разбирайся, что человек понимал под этим: “окислитель” или “окисление”? Задание С2. Типичная ошибка №1: взаимодействие металлов с азотной кислотой – подавляющее число участников пишет: Me + HNO3 →… + H2. При взаимодействии азотной кислоты с восстановителями восстанавливается нитрат-ион. Типичная ошибка №2: Не учитывается возможность протекания ОВР наряду с реакциями обмена, например: CuS + HNO3 → Cu(NO3)2 + H2S. – Азотная кислота, как уже говорилось – окислитель, сера в степени окисления (–2) – сильный восстановитель, поэтому протекает не реакция обмена, а ОВР: CuS + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O. Или: Fe2O3 + HI → FeI3 + H2O. – Железо (+3) – окислитель, иодид-ион хороший восстановитель, поэтому реальный процесс можно выразить схемой: Fe2O3 + HI → FeI2 + I2 + H2O. Обидные ошибки: схема реакции верная, а коэффициенты не расставлены. Если не смог, то ничего не поделаешь, а если от невнимательности, то обидно, баллы теряются. Типичная ошибка №2: Пишутся упрощенные уравнения реакций, не учитывающие среды, без указания неорганических продуктов: CH3CHO + Ag2O →CH3COOH + 2Ag – реакция идет в присутствии избытка аммиака, который, разумеется, реагирует с кислотой, продуктом является соль: CH3CHO + Ag2O + NH3 → CH3COONH4 + 2Ag; или еще точнее так: CH3CHO + 2[Ag(NH3)2]OH → CH3COONH4 + 3NH3 + 2Ag Или при окислении перманганатом пишется: C6H5CH3 + [O] → C6H5COOH - без рассмотрения, что там стало с перманганатом, какие еще продукты образуются…. Типичная ошибка №3: отсутствие коэффициентов. С2 Даны вещества: сера, гидроксид калия, азотная кислота, ортофосфорная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: магний, концентрированная серная кислота, азот, хлорид аммония. Напишите уравнения четырёх возможных реакций между этими веществами.
Даны вещества: сульфид свинца(11), сульфит натрия, пероксид водорода, концентрированная серная кислота. Напишите уравнения четырёх возможных реакций между этими веществами.
Даны вещества: сульфит калия, сероводород, серная кислота, раствор перманганата калия. Напишите уравнения четырёх возможных реакций между этими веществами.
Даны вещества: бром, сероводород, сернистый газ, концентрированная азотная кислота. Напишите уравнения четырёх возможных реакций между этими веществами.
Даны вещества: медь, хлорид железа(III), концентрированная азотная кислота, сульфид натрия. Напишите уравнения четырёх возможных реакций между этими веществами.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Cl2 КОН, спирт С акт, 650° KMnO4, H2SO4 этен → Х1 → Х2 → Х3 → толуол →Х4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
К раствору, полученному при добавлении 20 г гидрида калия к 500 мл воды, прилили 100 мл 32%-ного раствора соляной кислоты (плотностью 1,16 г/мл). Определить массовые доли веществ в полученном растворе. Элементы ответа: КH + Н2О = Н2 + КОН КОН + НС1 = КС1 + Н2О m(р-ра НС1) = р • V = 1,16 • 100 = 116 (г) m(HCl) = m(p-pa HCl) • w = 116 • 0,32 = 37,12 (г) n(HCl) = m(HCl): M(HCl) = 37,12 : 36,5 = 1,02 (моль) n(KOH) = n(KH) = m : M = 20 : 40 = 0,5 (моль) избыток HCl n(KCl) = n(KOH) = 0,5 (моль) m(KCl) = M • n = 74,5 • 0,5 = 37,25 (г) n(H2) = n(KH) = 0,5 (моль); m(H2) = M • n = 2 • 0,5 = 1 (г) n(изб.НС1) = 1,02 - 0,5 = 0,52 (моль) m(изб.НС1) = М • n = 36,5 • 0,52 = 18,98 (г) m(pacтвopa) = m(KH) + m(H2О) + m(p-pa HCl) - m(H2) = 20 + 500 + 116 - 1 = 635 (г) w(KCl) = m(KCl) : m(раствора) = 37,25 : 635 = 0,059, или 5,9% w(HCl) = m(изб.НС1): m(раствора) = 18,98 : 635 = 0,03, или 3% 27,2 г смеси карбидов кальция и алюминия обработали кислотой, получили 11,2 л смеси газов (при н.у.). Определить объёмную долю ацетилена в смеси. Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: СаС2 + 2НС1 = СаСl2 + С2Н2 М(СаС2) = 64 г/моль Al4C3 + 12НС1 = 4А1С13 + 3СН4 М(А14С3) = 144 г/моль n(СаС2) = n(С2Н2) = X n(А14С3) = у n(СН4) = Зу n(СН4 + С2Н2) = V : Vn, = 11,2 : 22,4 = 0,5 (моль) х + 3у = 0,5 => х = 0,2; у = 0,1 64х + 144у = 27,2 φ(С2Н2) = V(C2H2): V(CH4+C2H2) = n(C2H2): n(CH4+C2H2) = 0,2 : 0,5 = 0,4, или 40% Плотность паров органического вещества по кислороду равна 1,875. При сгорании 15 г этого вещества образуется 16,8л углекислого газа (при н.у.) и 18 г воды. Определите состав органического вещества. Элементы ответа: М(СхНуОz) = D • М(O2) = 1,875 • 32 = 60 (г/моль) n(CxHyOz) = m : М = 15 : 60 = 0,25 (моль) n(СO2) = V : Vm = 16,8 : 22,4 = 0,75 (моль) => n(С) = 0,75 (моль) n(Н2O) = m : М = 18 : 18 - 1 (моль) => n(Н) = 2 (моль) n(CxHyOz) : n(С) : n(Н) = 0,25 : 0,75 : 2 = 1 : 3 : 8 = > х = 3; у = 8 М(С3Н8Оz)=12 • 3 + 1 • 8 + 16 • Z 44 + 16•z = 60 => z = l Состав органического вещества C3H8O На полную нейтрализацию раствора, содержащего 18,5 г предельной одноосновной карбоновой кислоты, пошло 50 г 20%-ного раствора гидроксида натрия. Определите состав кислоты. Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла) Элементы ответа: 1) m(NaOH) - m(p-pa) • w(NaOH) = 50 • 0,2 = 10 (г) n(NaOH) = m : М = 10 : 40 = 0,25 (моль) CnH2n+1COOH + NaOH = CnH2n+1COONa + H2O n(CnH2n+1COOH) = n(NaOH) = 0,25 (моль) 2) M(CnH2n+1COOH) = m : n = 18,5 : 0,25 = 74 (г/моль) 12n + 2n + 1 + 12 + 16 • 2 + 1 = 74 => n = 2 Состав кислоты C2H5COOH В заданиях части С наиболее трудными оказались те, где нужно было показать знание следующих реакций: -взаимодействие комплексных солей К3[А1(ОН)6], К3[Сr (ОН)6] со слабыми кислотами (H2S, Н2О + СО2, Н2О + SO2) или кислыми растворами солей, сильно гидролизованных по катиону (FеСl3, А1С13, СrСl3); -реакции с участием Н2О2 как окислителя (с H2S, SO2, К3[Сr(ОН)6]); - разложение КСlO3; -взаимодействие растворов солей, образованных слабым основанием и слабой кислотой (СrСl3 и К2СО3, А1С13 и Na2S); - взаимодействие кислоты и её средней соли с образованием кислой соли (К2СО3 + Н2О + СО2; Na2S + H2S); - взаимодействие фосфора с концентрированными серной и азотной кислотами; -характеризующие свойства амфотерных оксидов (в том числе сплавление оксида алюминия с карбонатом натрия с образованием метаалюмината натрия и углекислого газа); - взаимодействие хлора со щелочами на холоду и при нагревании; - взаимодействие железа с азотной кислотой при разной степени её разбавления; -характеризующие свойства концентрированной серной и азотной кислот как окислителей в реакциях не только с металлами, но и с неметаллами, и со сложными вещества; - реакция Вюрца; - взаимодействие спиртового раствора щёлочи с галогенозамещёнными алканами; - алкилирование аминов; - алкилирование бензола и его гомологов; - получение ацетальдегида каталитическим окислением этилена. |