|
Всероссийская олимпиада школьников I (школьный) этап Химия 11 класс 2011 г
Всероссийская олимпиада школьников
I (школьный) этап
Химия
11 класс 2011 г.
Общее время выполнения работы – 2,5 часа.
Задание 1.
К 8% раствору хлорида алюминия постепенно добавили равную массу карбоната натрия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю карбоната натрия в исходном растворе.
Количество баллов – 10.
Задание 2.
В сосуде объемом 15,0 л находятся 3 моль PCl3 и 6 моль Cl2. При некоторой температуре в реакционной смеси установилось равновесие: PCl3(г) + Cl2(г) ↔ PCl5(г). Константа равновесия при этой температуре равна 25 моль/л. Вычислите число моль газообразного PCl5 в равновесной смеси.
Количество баллов – 10.
Задание 3.
Смесь массой 20 г, состоящая из метиламина, аминоуксусной кислоты и этилацетата может прореагировать с 4,93 л хлороводорода (н.у.). Эта же смесь массой 40 г может прореагировать с 300 мл 1,4 М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
Количество баллов – 10.
Задание 4.
На схеме приведена цепочка превращений вещества А, приводящая к образованию Д с плотностью паров по воздуху 9,93 и содержанием углерода 50 масс.%.
2[Ag(NH3)2]OH Сактивир. 6CH3Cl KMnO4, H2SO4 P2O5
Ag2C2←─−−−−−−−− A −−−−−−−−−→ Б −−−−−−−→ В −−−−−−−−−→ Г−−−−−→ Д
400°C AlCl3 (C12H6O12)
Приведите структурные формулы веществ А - Д, назовите их и напишите уравнения реакций
Количество баллов – 10.
Задание 5.
В пробирках находятся следующие вещества: фенол, изопропиловый спирт, глюкоза, глицерин и уксусная кислота. Используя в качестве реагентов сухую соль карбоната натрия, растворы брома, сульфата меди и гидроксида натрия, предложите способ определения содержимого каждой пробирки.
Количество баллов – 10.
Всероссийская олимпиада школьников
I (школьный) этап
Химия
11 класс 2011г.
Критерии проверки
Задание 1.
К 8% раствору хлорида алюминия постепенно добавили равную массу карбоната натрия. Смесь, образовавшуюся после реакции, отфильтровали и получили раствор, содержащий две соли с одинаковыми анионами и равными массовыми долями. Рассчитайте массовые доли веществ в полученном фильтрате и массовую долю карбоната натрия в исходном растворе.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
По окончании реакции в растворе содержатся соли AlCl3 и NaCl
|
1
|
2/3x x 2x 2x 2/3x x
2AlCl3 + 3Na2CO3 + 6H2O = 6NaCl + 2Al(OH)3↓ + 3CO2↑
|
2
|
Пусть масса исходного раствора AlCl3 равна m г
М(NaCl) = 58,5 г/моль, М(AlCl3) =133,5 г/моль
Так как в конечном растворе по условию ω(NaCl) = ω(AlCl3), составляем уравнение: 58,5∙2х = 0,08m – 2/3х∙133,5, или m =2575х
|
1
1
1
|
mфильтрата =2m - m(Al(OH)3) –m(CO2) = 2∙2575x – 2/3x∙78 – 44x = 5054x
|
2
|
Таким образом, в конечном растворе массовые доли солей составляют:
ω(AlCl3) = ω(NaCl) = (2х∙58,5)/5054х = 0,0231 (2,31%)
|
1
|
В исходном растворе: ω(Na2CO3) = 106х/m =106x/2575x = 0,0412 (4,12%)
|
1
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 2.
В сосуде объемом 15,0 л находятся 3 моль PCl3 и 6 моль Cl2. При некоторой температуре в реакционной смеси установилось равновесие: PCl3(г) + Cl2(г) ↔ PCl5(г). Константа равновесия при этой температуре равна 25 моль/л. Вычислите число моль газообразного PCl5 в равновесной смеси.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Константа равновесия этой газофазной реакции имеет вид:
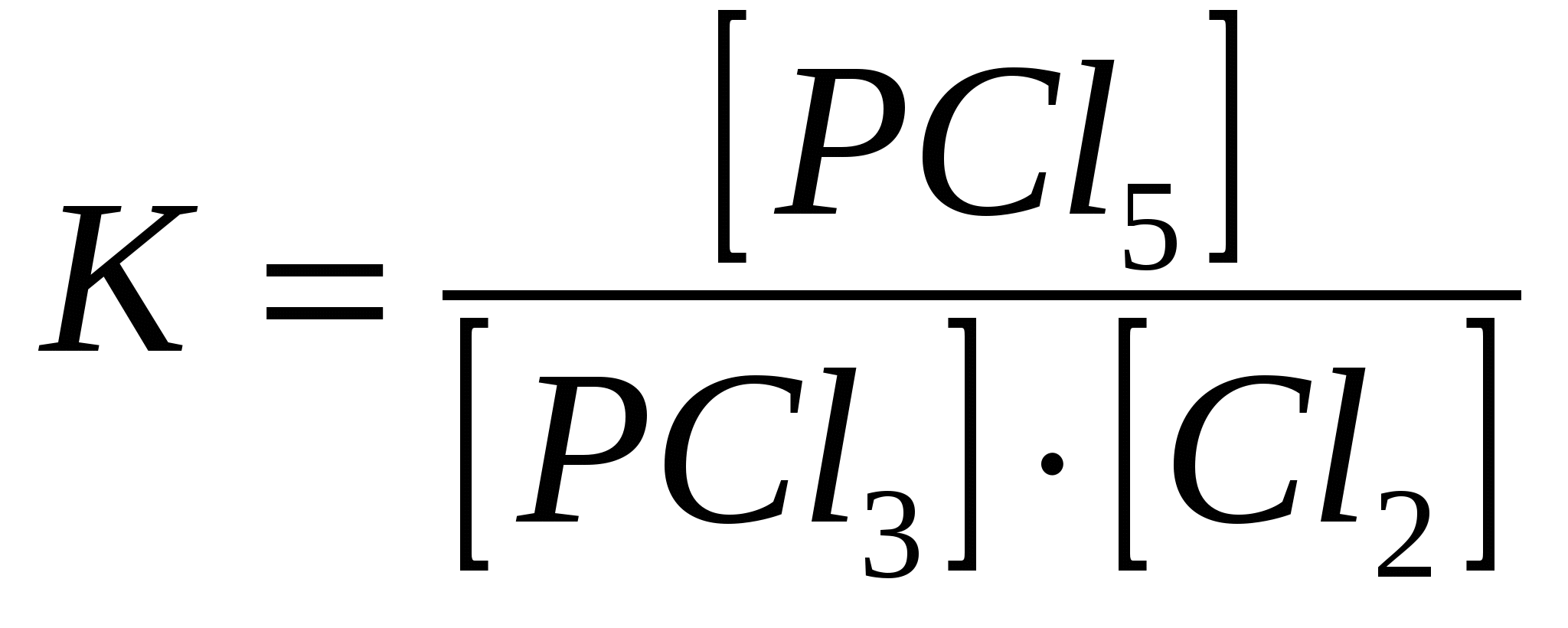
|
2
|
Молярная концентрация PCl3 в сосуде равна [PCl3] = 3/15 = 0,2 (моль/л), концентрация хлора [Cl2] = 6/15 = (0,4 моль/л).
|
0,5
0,5
|
Обозначим равновесную концентрацию PCl5 через х.
При достижении равновесия концентрации веществ будут следующие:
PCl3(г) + Cl2(г) ↔ PCl5(г).
0,2–х 0,4 –х х
|
1
1
|
Выразим константу равновесия через эти концентрации:
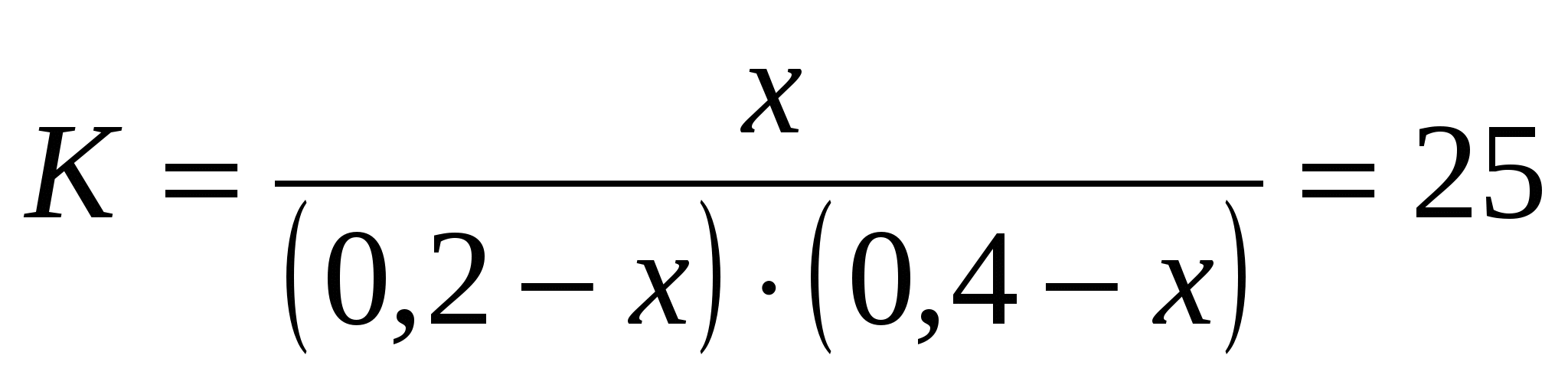
|
2
|
Решим полученное квадратное уравнение, из двух его корней выбрав тот, значение которого меньше 0,2:
25 = х/[(0,2–х)∙(0,4–x)];
x2 – 0,64x +0,08 = 0
x = 0,17 (моль/л).
|
1
1
|
В 15 л находится 0,17∙ 15 = 2,55 (моль) PCl5
|
1
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 3.
Смесь массой 20 г, состоящая из метиламина, аминоуксусной кислоты и этилацетата может прореагировать с 4,93 л хлороводорода (н.у.). Эта же смесь массой 40 г может прореагировать с 300 мл 1,4 М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
С хлороводородом реагируют метиламин и аминоуксусная кислота (глицин):
CH3NH2 + HCl →[CH3NH3]+Cl–; H2NCH2COOH + HCl → [H3NCH2COOH]+Cl–
|
2
|
C гидроксидом калия могут реагировать глицин и этилацетат:
H2NCH2COOH + KOH → H2NCH2COOK + H2O;
CH3COOC2H5 + KOH → CH3COOK + C2H5OH
|
1
1
|
Количество хлороводорода 4,93/22,4 = 0,22 (моль),
гидроксида калия 0,3∙1,4 = 0,42 (моль)
|
0,75
0,75
|
Обозначив за x, y и z количества метиламина, глицина и этилацетата в смеси массой 20 г, составим систему из 3 уравнений:
3 1x + 75y + 88z = 20 1x + 75y + 88z = 20
x + y = 0,22
2y + 2z = 0,42 , решая которую получим х = 0,1; y = 0,12; z =0,09
|
3
|
Массовые доли метиламина, глицина и этилацетата в смеси:
ω(CH3NH2) = (31∙0,09)/20 = 0,15 (15%)
ω(H2NCH2COOH) = (75∙0,12)/20 = 0,45 (45%)
ω(CH3COOC2H5) = (88∙0,09)/20 = 0,40 (40%)
|
0,5
0,5
0,5
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 4.
На схеме приведена цепочка превращений вещества А, приводящая к образованию Д с плотностью паров по воздуху 9,93 и содержанием углерода 50 масс.%.
2[Ag(NH3)2]OH Сактивир. 6CH3Cl KMnO4, H2SO4, t° P2O5
Ag2C2←─−−−−−−−− A −−−−−−−−−→ Б −−−−−−−→ В −−−−−−−−−→ Г−−−−−→ Д
400°C AlCl3 (C12H6O12)
Назовите вещества А - Д и напишите уравнения реакций.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
А - ацетилен, который однозначно определяется по реакции с аммиачным раствором оксида серебра:
С2Н2 + 2[Ag(NH3)2]OH → Ag2C2 + 2NH4Cl + 2 NH3водн.
|
1
|
Из плотности паров находим молекулярную массу Д:
Мr= 29∙9,93 = 288 (а.е.м.). Учитывая, что оно содержит 50% углерода, т.е. 144 а.е.м., в его состав входит 12 атомов углерода. Оставшиеся 144 а.е.м. это ровно 9 атомов кислорода, т.е. от исходной молекулы C12H6O12 отняли ровно 3 молекулы воды. ( Можно просто увидеть, что 288 отличается от молекулярной массы C12H6O12 на 54 а.е.м, что в реакции с таким известным водоотнимающим агентом, как P2O5, наверняка означает удаление 3-х молекул воды). Таким образом формула вещества Д - С12О9.
|
1
1
|
3С2Н2 →С6Н6(активированный уголь,400°С),
Б - бензол
|
1
|
С6Н6 + 6CH3Cl → С6(СН3)6 + 6HCl (в присутствии AlCl3)
В - гексаметилбензол
|
2
|
5С6(СН3)6 +36KMnO4 +54H2SO4 → 5C6(COOH)6 +36MnSO4 +18 K2SO4 +84H2O (кипячение)
Г - бензолгексакарбоновая кислота (меллитовая кислота)
|
2
|
C6(COOH)6 + 3P2O5 → С12О9 + 6HPO3
Д - ангидрид бензолгексакарбоновой кислоты (меллитовый ангидрид)
|
2
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
10
|
Задание 5.
В пробирках находятся следующие вещества: фенол, изопропиловый спирт, глюкоза, глицерин и уксусная кислота. Используя в качестве реагентов сухую соль карбоната натрия, растворы брома, сульфата меди и гидроксида натрия, предложите способ определения содержимого каждой пробирки.
Решение:
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Составим таблицу возможных взаимодействий веществ, в результате которых мы будем (или не будем) наблюдать определённые признаки реакций.
|
2
|
|
Фенол
|
Изопропиловый спирт
|
Глюкоза
|
Уксусная кислота
|
Глицерин
|
|
Na2CO3
|
|
|
|
|
|
|
CuSO4 NaOH
|
|
|
Синее окрашивание раствора, при нагревании изменяющий свой цвет на желтый, а затем на красный
|
|
Синее окрашивание раствора.
|
|
Br2/Н2О
|
|
|
|
|
|
|
Определение проводят действием реагентов в указанном порядке, последовательно, исключая установленные вещества.
|
|
|
Na2CO3 + 2СН3СООН 2СН3СООNa + СО2 + Н2О
|
2
|
|
СН2–ОН–(СНОН)4–СН=О+2Cu(OH)2 CН2–ОН–(СНОН)4–СООН +Cu2O + 2Н2О
|
2
|
|
H
  CH2OH CH2–––– O O–––––CH2 CH2OH CH2–––– O O–––––CH2
  | Cu | Cu
2CHOH + Cu(OH)2 CH––––– O O ------CH + 2H2O
CH2OH CH2OH H CH2OH
|
2
|
|
C6H5OH + 3Br2 →C6H2(OH)Br3 +3HBr
|
2
|
|
Все элементы ответа записаны неверно
|
0
|
|
Максимальный балл
|
10
|
| |
|
|
 Скачать 92.21 Kb.
Скачать 92.21 Kb. 1x + 75y + 88z = 20
1x + 75y + 88z = 20
 CH2OH CH2–––– O O–––––CH2
CH2OH CH2–––– O O–––––CH2
 | Cu
| Cu