Элективный курс «Подготовка учащихся к егэ по химии»
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
Задание 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия. Напишем схему реакции - формулы исходных и полученных веществ: Н2S + КМnO4 + Н2SО4 → S + МnSО4 + К2SO4 + Н2О Затем покажем изменение степеней окисления атомов до и после реакции: Изменяются степени окисления у атомов серы и марганца (Н2S - восстановитель, КМnО4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов: И наконец, находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль Н2S и 2 моль КМnО4, тогда получим 5 моль атомов S и 2 моль МnSО4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль К2SО4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид 5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2.4 + 3.4 = 20 и в правой части 2.4 + 4 + 8 = 20. Переписываем уравнение в ионной форме: 5Н2S + 2MnO4- + 6H+ = 5S + 2Мn2+ + 8Н2О Известно, что правильно написанное уравнение реакции является выражением закона сохранения массы веществ. Поэтому число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. Должны сохраняться и заряды. Сумма зарядов исходных веществ всегда должна быть равна сумме зарядов продуктов реакции.
Алгоритм написания окислительно-восстановительных реакций методом полуреакций
Как показывает самоназвание, этот метод основан на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса. При пропускании сероводорода Н2S через подкисленный раствор перманганата калия КМnО4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнение раствора происходит в результате образования элементной серы,т.е. протекания процесса: Н2S → S + 2H+ Эта схема уравнена по числу атомов. Для уравнивания по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенства: Н2S - 2е- = S + 2H+ Это первая полуреакция - процесс окисления восстановителя Н2S. Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску) в ион Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой MnO4- → Mn2+ В кислом растворе кислород, входящий в состав ионов МnО4, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так: MnO4- + 8Н+→ Мn2+ + 4Н2О Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (7+), а конечные - два положительных(2+), то для выполнения условия сохранения зарядов надо к левой части схемы прибавить пять электронов: MnO4- + 8Н+ + 5e-= Mn2+ + 4Н2О Это вторая полуреакция - процесс восстановления окислителя, т.е. перманганат-иона Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций.Сокращенно запись проводится так: 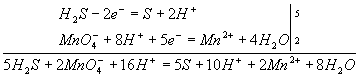 И, сократив на 10Н+, окончательно получим 5Н2S + 2MnO4- + 6H+ = 5S + 2Mn2+ + 8Н2О Проверяем правильность составленного в ионной форме уравнения: число атомов кислорода в левой части 8, в правой 8; число зарядов: в левой части (2-)+(6+) = 4+, в правой 2(2+) = 4+. Уравнение составлено правильно, так как атомы и заряды уравнены. Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону - анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы: 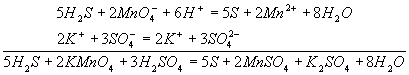 Таким образом, составление уравнений окислительно-восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса. Сопоставим оба метода. Достоинство ыметода полуреакций по сравнению с методом электронного баланса в том. что в нем применяются не гипотетические ионы,а реально существующие. В самом деле, в растворе нет ионов При методе полуреакций не нужно знать степень окисления атомов. Написание отдельных ионных уравнений полуреакций необходимо для понимания химических процессов в гальваническом элементе и при электролизе. При этом методе видна роль среды как активного участника всего процесса. Наконец,при использовании метода полуреакций не нужно знать все получающиеся вещества, они появляются в уравнении реакции при выводе его. Поэтому методу полуреакций следует отдать предпочтение и применять его при составлении уравнений всех окислительно-восстановительных реакций, протекающих в водных растворах. Заключение В результате, анализируя методику предложенного элективного курса, можно сделать следующие выводы: 1. Элективный курс в современных условиях представляет собой наиболее оптимальную форму для организации дополнительной подготовки учащихся к ЕГЭ по химии; 2. Анализ результатов ЕГЭ по химии позволяет сделать вывод, что затруднения у выпускников вызывает выполнение части С, а именно, задания на темы: «Электролиз», «Растворы», «Генетическая связь между классами неорганических и органических соединений», «Вывод химических формул», «ОВР». Поэтому следует обращать внимание на изучение этих тем при подготовке учащихся к экзамену; 3. Составленный перечень заданий соответствует содержанию и структуре ЕГЭ по химии и отвечает требованиям, предъявляемым к выпускникам. В них включены как задания с рассмотрением решения, так и задания, предназначенные для самостоятельной работы. Список литературы
|