Элективный курс «Подготовка учащихся к егэ по химии»
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
| Тема №5. Окислительно-восстановительные реакции Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления (с.о.) элементов, образующих реагирующие вещества. Окислитель – вещество (элемент, в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается. Восстановитель - вещество (элемент, в составе этого вещества), отдающее электроны. Следует помнить, что к ОВР относятся все реакции замещения (для неорганических веществ), а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество. Ориентиром для отнесения конкретной реакции к ОВР служит наличие формулы простого вещества в схеме или уравнении химической реакции. Типичные окислители
Типичные восстановители
Различают три основных типа окислительно-восстановительных реакций: 1) Реакции межмолекулярного окисления-восстановления (когда окислитель и восстановитель – разные вещества); 2) Реакции диспропорционирования (когда окислителем и восстановителем может служить одно и то же вещество); 3) Реакции внутримолекулярного окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя). Рассмотрим примеры реакций трех типов. 1. Реакциями межмолекулярного окисления-восстановления являются все уже рассмотренные нами в этом параграфе реакции. Рассмотрим несколько более сложный случай, когда не весь окислитель может быть израсходован в реакции, поскольку часть его участвует в обычной – не окислительно-восстановительной реакции обмена:
Часть частиц NO3- участвует в реакции в качестве окислителя, давая оксид азота NO, а часть ионов NO3- в неизменном виде переходит в соединение меди Cu(NO3)2. Составим электронный баланс: 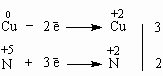 Поставим найденный для меди коэффициент 3 перед Cu и Cu(NO3)2. А вот коэффициент 2 следует поставить только перед NO, потому что весь имеющийся в нем азот участвовал в окислительно-восстановительной реакции. Было бы ошибкой поставить коэффициент 2 перед HNO3, потому что это вещество включает в себя и те атомы азота, которые не участвуют в окислении-восстановлении и входят в состав продукта Cu(NO3)2 (частицы NO3- здесь иногда называют “ионом-наблюдателем”). Остальные коэффициенты подбираются без труда по уже найденным: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O 2. Реакции диспропорционирования происходят тогда, когда молекулы одного и того же вещества способны окислять и восстанавливать друг друга. Это становится возможным, если вещество содержит в своем составе атомы какого-либо элемента в промежуточной степени окисления. Следовательно, степень окисления способна как понижаться, так и повышаться. Например:
Эту реакцию можно представить как реакцию между HNO2 и HNO2 как окислителем и восстановителем и применить метод электронного баланса:
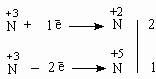 Получаем уравнение: 2HNO2 + 1HNO2 = 1HNO3 + 2NO + H2O Или, складывая вместе моли HNO2: 3HNO2 = HNO3 + 2NO + H2O 3. Реакции внутримолекулярного окисления-восстановления происходят тогда, когда в молекуле соседствуют атомы-окислители и атомы-восстановители. Рассмотрим разложение бертолетовой соли KClO3 при нагревании:
Это уравнение также подчиняется требованию электронного баланса: 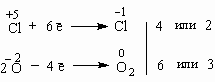 Здесь возникает сложность – какой из двух найденных коэффициентов поставить перед KClO3 – ведь эта молекула содержит и окислитель и восстановитель? В таких случаях найденные коэффициенты ставятся перед продуктами: KClO3 = 2KCl + 3O2 Теперь ясно, что перед KClO3 надо поставить коэффициент 2. 2KClO3 = 2KCl + 3O2 Внутримолекулярная реакция разложения бертолетовой соли при нагревании используется при получении кислорода в лаборатории. Мы рассмотрели важнейшие типы окислительно-восстановительных реакций и метод электронного баланса, но пока не касались вопроса составления уравнений таких реакций. Распространенное заблуждение заключается в том, что вы можете сразу предсказать продукт (или продукты) окислительно-восстановительной реакции. Это не так. Лишь по мере накопления опыта, особенно в лаборатории, вы сможете делать все больше и больше правильных предсказаний. А пока следует научиться уравнивать реакции, реагенты и продукты которых заранее известны.
Степень окисления – это условный заряд атома в молекуле или кристалле. Его определяют, условно считая все полярные связи полностью ионнымии. Степень окисления выражают числом частично или полностью смещенных электронов от одного атома к другому в их соединении. Если атом отдал электроны, его степени окисления приписывается знак “+”, а если атом принял электроны, то знак “-”. Возможна и нулевая степень окисления атома в молекуле, если электроны никуда не смещались или число отданных и принятых электронов одинаково. Степень окисления - очень важная величина, относящаяся к основным понятиям химии. Фактически, степень окисления описывает состояние атома в соединении. Есть несколько полезных правил, которые касаются степеней окисления: 1) Степень окисления атома любого элемента в свободном состоянии равна нулю. Это связано с тем, что в чисто ковалентных двухатомных молекулах электроны не смещены ни к одному из атомов. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю. Примеры молекул, где степени окисления атомов равны нулю: H2, Fe, F2, Na, O2, N2, Ar. 2) Степень окисления любого простого одноатомного иона равна его заряду. Примеры: H+ (+1), Fe3+ (+3), F– (-1), Na+ (+1). 3) Степень окисления водорода в его соединениях с другими элементами равна +1. Примеры молекул, где водород имеет степень окисления +1: H2O, NH3, CH4, HF, HCl. Исключение составляют довольно редкие соединения - гидриды металлов (например, LiH), в которых степень окисления водорода равна -1, потому что электроотрицательность металлов меньше, чем у водорода. 4) Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О. Примеры молекул, где кислород имеет степень окисления –2 (таких соединений кислорода – подавляющее большинство): H2O, SO2, SO3, NO2. Положительную степень окисления кислород проявляет только в соединениях с фтором (например, в соединении OF2, где степень окисления кислорода равна +2). 5) Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю. 6) Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах. 1. Какие из указанных ниже соединений могут проявлять только окислительные свойства? CrSO4 ; K2CrO4 ; NaCrO2 . Решение. Из предложенных соединений только окислительными свойствами обладает K2CrO4 , так как Сr в данном соединении проявляет высшую степень окисления + 6 и, следовательно, может только принимать электроны. В соединениях CrSO4 ; NaCrO2 хром проявляет промежуточные степени окисления +2 и +3 соответственно и может выполнять как функцию окислителя, так и функцию восстановителя. Ответ: K2CrO4 . 2. Укажите, какие из приведенных процессов являются процессами окисления: а) SO2 → S2– ; б) ClO– → Cl– ; в) CrO2– → CrO42– . Решение. Процессом окисления называется отдача атомом электронов, сопровождающаяся повышением его степени окисления. В данном случае таким процессом будет процесс : CrO2– → CrO42–. В этом превращении у хрома степень окисления меняется следующим образом: Сr3+ – 3e- → Cr6+ , а в других случаях: а) S4+ + 6e- → S2– ; б) Cl+ + 2e- → Cl– Ответ: в) 3. Укажите, какие из реакций являются окислительно-восстановительными: а) 2Al + Cr2O3 → Al2O3 + 2Cr ; б) Al2(SO4)3 + 6 NaOH → 2Al(OH)3 + 3Na2SO4 ; в) Al(OH)3 + NaOH → Na[Al(OH)4] . Решение. Окислительно-восстановительными называются такие реакции, в результате которых изменяется степень окисления одного или нескольких участвующих в реакции элементов. В случае а) меняется степень окисления у двух элементов Al и Cr, в случаях б) и в) элементы, участвующие в реакциях, не меняют свою степень окисления. Ответ: а). 4. Уравняйте методом электронного баланса уравнения окислительно-восстановительных реакций и укажите количество молекул окислителя: Na2MoO4 + HCl + Al → MoCl2 + AlCl3 + NaCl + H2O Решение. В данном процессе степень окисления меняют два элемента: Mo и Al: Mo6+ → Mo2+ ; Al0 → Al3+ Записываем для этих элементов уравнения электронного баланса и подбором коэффициентов уравниваем число отданных и принятых электронов (коэффициенты записываются справа от уравнений за вертикальной чертой):
Из уравнений электронного баланса переносим коэффициенты в уравнение окислительно-восстановительной реакции: 3Na2MoO4 + HCl + 4Al → 3MoCl2 + 4AlCl3 + NaCl + H2O, затем выравниваем число остальных атомов, кроме водорода и кислорода: 3Na2MoO4 + 24HCl + 4Al → 3MoCl2 + 4AlCl3 + 6NaCl + H2O, выравниваем число атомов водорода: 3Na2MoO4 + 24HCl + 4Al → 3MoCl2 + 4AlCl3 + 6NaCl + 12H2O, проверяем уравнение по кислороду (в левой и правой части уравнения число атомов кислорода должно быть одинаково). Окислителем в данной реакции является Na2MoO4 . Ответ: 3. Решение заданий. Задание 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных и конечных веществ реакции и покажем изменения степеней окисления: Медь, образуя ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь - восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) -окислитель. Эти изменения можно выразить электронными уравнениями из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение реакции: Cu + Pd(NO3)2 = Cu(NO3)2 + Pd Как видно, в суммарном уравнении реакции электроны не фигурируют. Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в его правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно. Переписываем это уравнение в ионной форме: Cu + Pd2+ + 2NO3- = Cu2+ + 2NO3- + Рd И после сокращения одинаковых ионов получим Cu + Pd2+ = Cu2+ + Pd Задание 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор). Запишем формулы исходных и конечных веществ реакции: НCl + МnО2 → Сl2 + MnСl2 + Н2О Покажем изменение степеней окисления атомов до и после реакции: Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и марганца. НCl - восстановитель, MnО2 — окислитель. Составляем электронные уравнения: и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении: 2НСl + MnO2 → Сl2 + MnСl2 + Н2О Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnО2. Однако, учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид 4НCl + МnО2 = Сl2 + MnСl2 + 2Н2О Проверку правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2 + 2 = 4. Поскольку в методе электронного баланса изображаются уравнения реакций в молекулярной форме, то после составления и проверки их следует написать в ионной форме. Перепишем составленное уравнение в ионной форме: 4Н+ + 4Сl- + МnО2 = Сl2 + Мn2+ + 2Сl- + 2Н2О и после сокращения одинаковых ионов в обеих частях уравнения получим 4Н+ + 2Cl- + MnO2 = Сl2 + Mn2+ + 2Н2О |