|
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и). Принцип Ле Шателье. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности

Тема урока: Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление и). Принцип Ле Шателье. Роль смещения химического равновесия в увеличении выхода продукта в химической промышленности
Состояние химического равновесия обратимой реакции сохраняется при неизменных условиях (концентрация, температура и давление), но стоит только хотя изменить хотя бы одно из условий протекания реакции, как равновесие быстро перейдет в другое состояние, соответствующее новым условиям.

Переход реакции из одного равновесного состояния в другое равновесное состояние, отвечающее изменившимся условиям, называют смещением равновесия

Принцип Ле Шателье Если изменить одно из условий, при которых реакция находится в состоянии равновесия (концентрация, температура или давление), то равновесие сместится в направлении той реакции, которая сместится в направлении той реакции, которая противодействует этому изменению

Ле Шателье Анри Луи

Изменение концентрации При увеличении концентрации одного из веществ (исходное или продукт) равновесие смещается в сторону его расходования
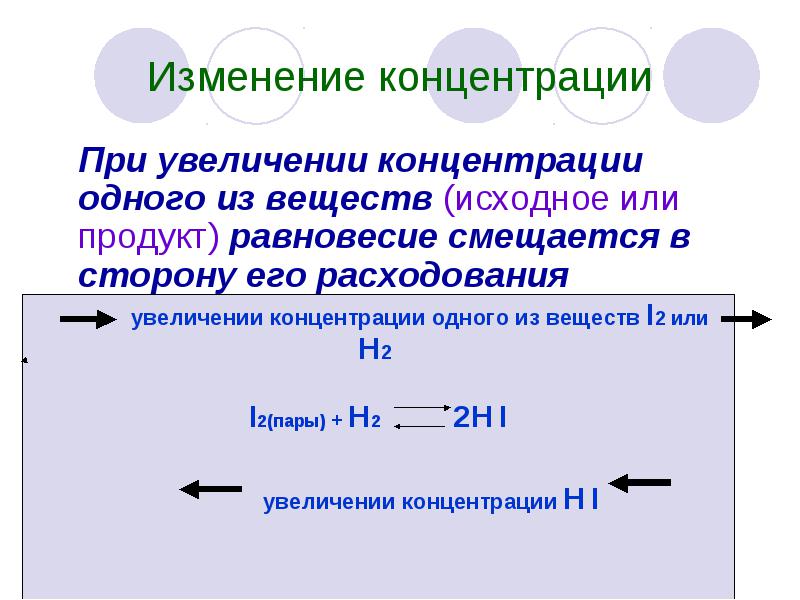
Изменение концентрации

В обратимых гетерогенных реакциях введение дополнительной массы твердого вещества не влияет на состояние равновесия tCaCO3(тв.) СaO(тв.) + CO2 (г)

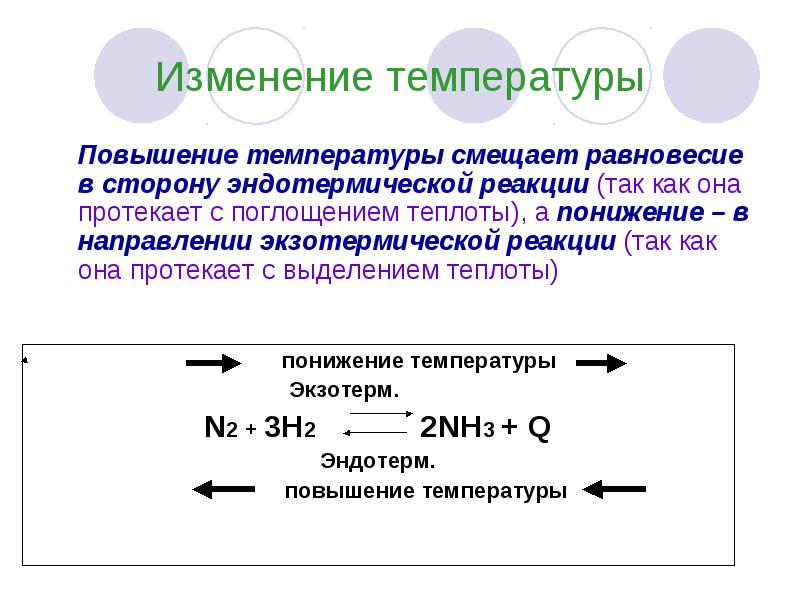
Изменение температуры Повышение температуры смещает равновесие в сторону эндотермической реакции (так как она протекает с поглощением теплоты), а понижение – в направлении экзотермической реакции (так как она протекает с выделением теплоты)
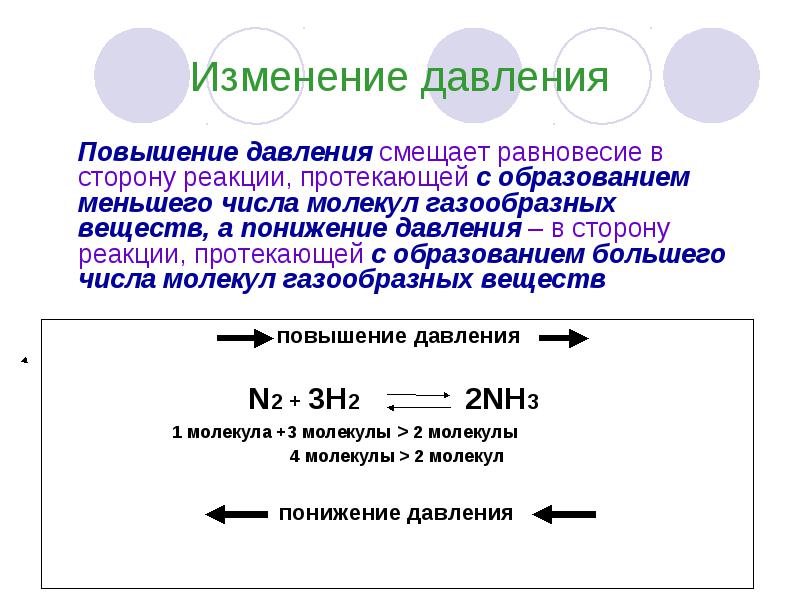
Изменение давления

Изменение давления Повышение давления смещает равновесие в сторону реакции, протекающей с образованием меньшего числа молекул газообразных веществ, а понижение давления – в сторону реакции, протекающей с образованием большего числа молекул газообразных веществ
Изменение давления Если реакция протекает без изменения числа молекул газообразных веществ, то изменение давления не влияет на состояние равновесия этой системы, так как давление в системе не изменяется

Введение катализатора Введение в реакцию катализатора не влияет на состояние химического равновесия, так как катализатор снижает энергию активации прямой и обратной реакций на одну и туже величину, следовательно он в одинаковой степени изменяет скорость как прямой, так и обратной реакции. Катализатор только ускоряет достижение химического равновесия




Рассмотрим вторую стадию получения серной кислоты: Каталитическое окисление оксида серы (IV) до оксида серы (VI) Реакция между оксида серы (IV) и кислородом экзотермическая и равновесная.

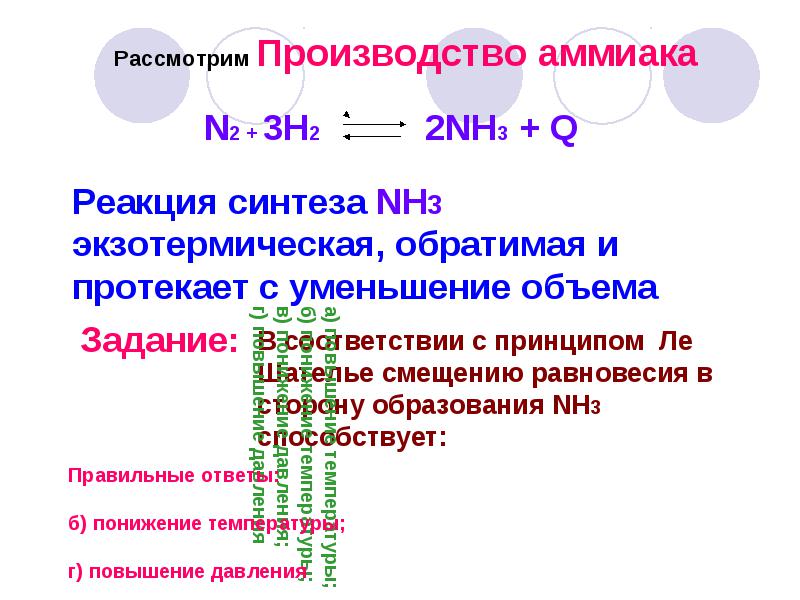
Рассмотрим Производство аммиака Реакция синтеза NH3 экзотермическая, обратимая и протекает с уменьшение объема
Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ Влияние изменения концентрации реагирующих веществ на химическое равновесие исследуем на примере реакции между хлоридом железа (III) и роданитом калия:FeCL3 + 3KSCN Fe(SCN)3 + 3 KCL

Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ Красное окрашивание роданида железа (III) позволяет следить за сдвигом химического равновесия при изменении концентрации реагирующих веществ.

Описание опыта №1 Смещение химического равновесия при изменении концентрации реагирующих веществ


Л. О. №1 Смещение химического равновесия при изменении концентрации реагирующих веществ

Дом. Задание : параграф 17, задание 2 стр. 101
 |
|
|
























 Скачать
Скачать