Урок химии в 9 классе. Автор Ицкович Т. Я. учитель химии мбоу оош №81 г. Краснодар 2012 Цель урока
 Скачать 90.14 Kb. Скачать 90.14 Kb.
|
| МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81  Урок химии в 9 классе.  Автор Ицкович Т.Я. учитель химии МБОУ ООШ №81 г.Краснодар 2012 Цель урока Формирование понятий о скорости химической реакции, зависимости скорости гомогенных и гетерогенных реакций от различных факторов (природы реагирующих веществ, температуры, концентрации веществ, площади соприкосновения реагирующих веществ, наличия катализатора). Задачи: Образовательные:
Воспитательные:
Развивающие:
Оборудование:
Ход урока: I. Организационный этап II Проверка домашнего задания Трёхуровневая проверочная работа. Из трех вопросов , предложенных в каждом варианте, учащиеся выбирают один пожеланию отвечают на него. На слайде учитель демонстрирует ответ и оценку правильного ответа III. Активизация познавательной деятельности учащихся. Учитель. Химические реакции сопровождают человека всю жизнь. Процессы жизнедеятельности, протекающие в нашем организме, процессы приготовления пищи, процессы получения металлов, процессы синтеза полимеров и других материалов, без которых нельзя представить жизнь современного человека. Все это – химические реакции. Некоторые реакции нежелательны для человека, поэтому бывает необходимо замедлить их, а скорость некоторых необходимо увеличить. Для этого надо знать факторы, которые влияют на скорость химической реакции. Изучением этих факторов и их влиянием на скорость химических реакций займемся на сегодняшнем уроке. (сообщение темы и цели урока.) IV. Этап изучения нового материала. Учитель: А сейчас переходим к изучению нового материала. Откройте рабочие тетради, запишите дату и тему урока. Каждая группа получает задание изучить на опыте влияние одного из факторов, влияющих на скорость химической реакции, а затем ознакомит всех с результатами ваших опытов. Всё необходимое оборудование, реактивы и инструкции для вашей работы есть на ваших столах. Будьте внимательны. Соблюдайте правила техники безопасности при работе со спиртовкой, при нагревании веществ, при работе с кислотами. (Каждая группа получает инструкцию для работы) (Приложение1). Учащиеся оформляют результаты Лабораторные опыты Условия, влияющие на скорость химической реакции. Дата : Оборудование: Реактивы:
V. Отчет групп о проделанной работе ( по мере отчета можно использовать презентацию) По мере обсуждения учитель оформляет опорный конспект. Затем демонстрирует его на слайде Опорный конспект к уроку 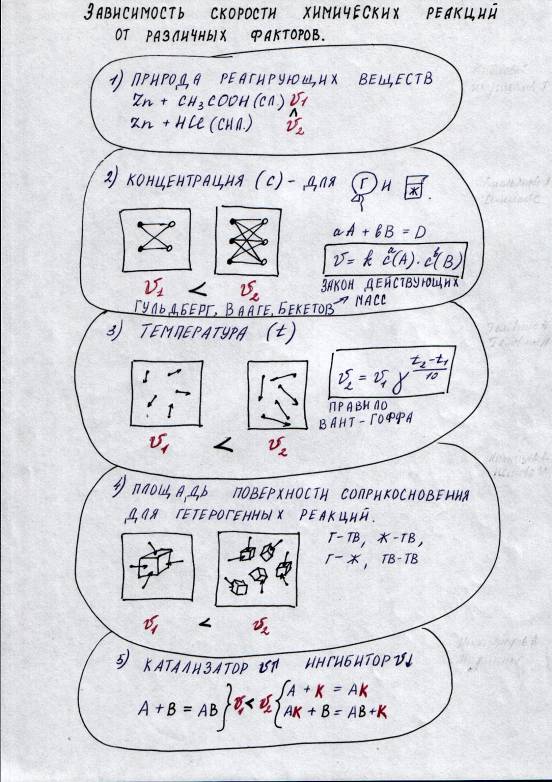 VI. Этап проверки понимания учащимися нового материала (проговаривание опорного конспекта.) VII. Итоги урока Учитель: Знание влияния различных факторов на скорость химической реакции широко применяется в промышленности. Например, при производстве серной кислоты. Колчедан перед обжигом измельчают для увеличения площади поверхности соприкосновения реагирующих веществ Для увеличения скорости различных реакции в неорганическом, а особенно в органическом синтезе широко используются катализаторы. Многие реакции в промышленности идут при высокой температуре. При современном уровне развития промышленности знания о скорости химической реакции и о факторах, влияющих на неё, позволяют повышать производительность и экономить ресурсы. Сообщение оценок за урок. VIII. Информация о домашнем задании, завершение урока Приложение 1 Инструкции для работы в группах Инструкция № 1 Влияние концентрации веществ на скорость химической реакции Даны вещества: Zn, р-р HCl (1:1) (на 1 часть концентрированной HCl приходится 1 часть воды), р-р HCl (1:10) (на 1 часть концентрированной HCl приходится 10 частей воды). Проделайте следующие опыты: (Внимание! Соблюдайте технику безопасности при обращении с кислотами!)  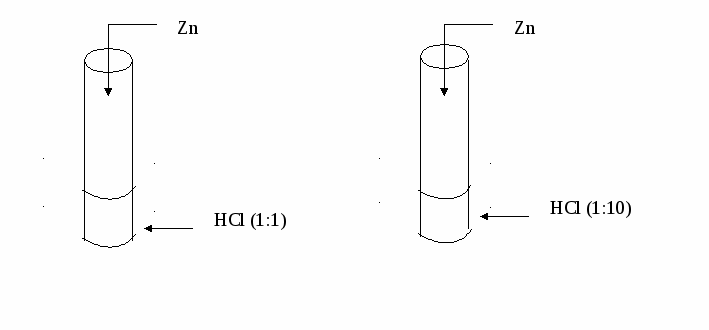 Сформулируйте вывод. Прочитайте текст учебника и подготовьте ответы на следующие вопросы:
Подготовьте ответы для сообщения Инструкция № 2 Влияние температуры на скорость химической реакции Даны вещества: Zn, р-р HCl в двух пробирках. Проделайте следующие опыты: (Внимание! Соблюдайте технику безопасности при обращении с кислотами, при нагревании и при обращении со спиртовкой. Будьте осторожны при нагревании HCl, т. К. она летуча, пары её ядовиты, ни в коем случае не доводите её до кипения!) 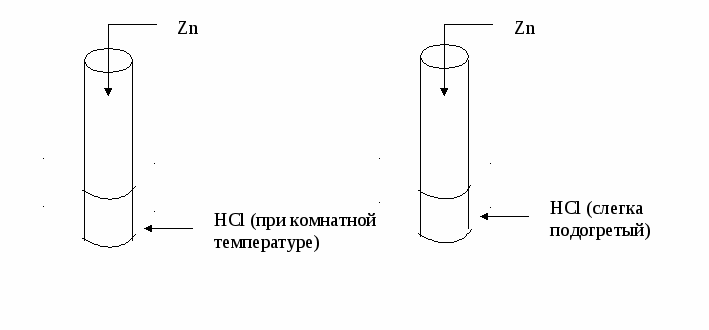 Сформулируйте вывод. Прочитайте текст учебника и подготовьте ответы на следующие вопросы:
Инструкция № 3 Влияние природы реагирующих веществ на скорость химической реакции Даны вещества: Zn, р-ры HCl (соляной кислоты) и СН3СООН (уксусной кислоты) одинаковой концентрации. Проделайте следующие опыты: (Внимание! Соблюдайте технику безопасности при обращении с кислотами!) 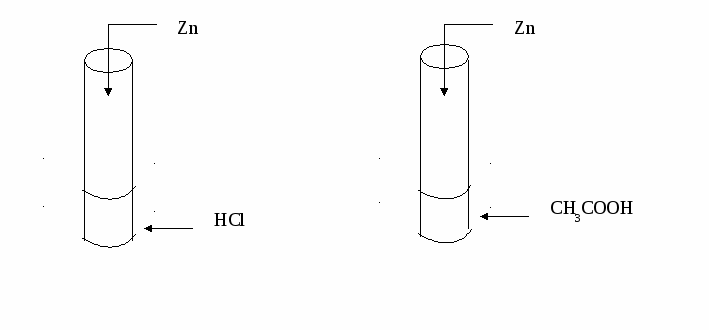 Сформулируйте вывод. Подготовьте ответы на следующие вопросы:
Инструкция № 4 Влияние площади соприкосновения реагирующих веществ на скорость химической реакции Даны вещества: мрамор СаСО3 (порошок), мрамор СаСО3 (неизмельченный), р-р HCl. Проделайте следующие опыты: (Внимание! Соблюдайте технику безопасности при обращении с кислотами!) 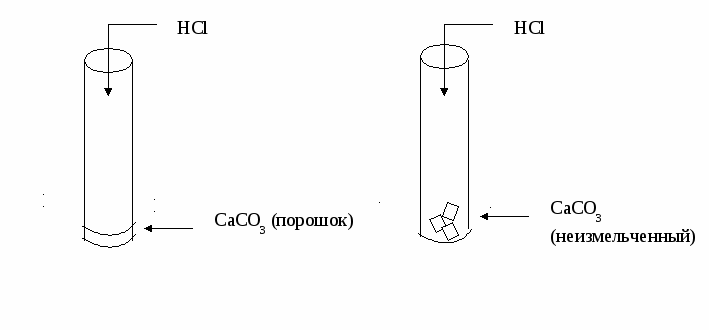 Сформулируйте вывод. Подготовьте ответы на следующие вопросы:
Инструкция № 5 Влияние катализатора на скорость химической реакции Даны вещества: Al, р-р CuSO4, поваренная соль NaCl (кристаллическая). Проделайте следующие опыты: 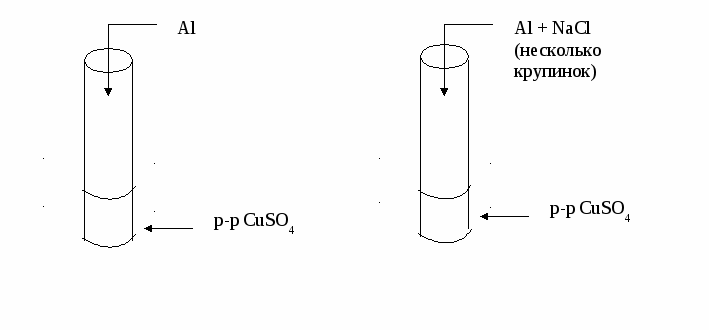 Сформулируйте вывод. Прочитайте текст учебника (до гомогенного катализа) и подготовьте ответы на следующие вопросы:
|