Статья: «Реализация межпредметных связей и роль химического эксперимента при изучении химического равновесия в 11 классе»
 Скачать 143.04 Kb. Скачать 143.04 Kb.
|
| Статья: «Реализация межпредметных связей и роль химического эксперимента при изучении химического равновесия в 11 классе» ISBN 978-5-4386-0565 ФГКОУ СПБ СВУ РФ, 2014 Издательство ФГКОУ СПБ СВУ РФ «… под равновесием мы понимаем состояние, в котором свойства системы, определенные экспериментально, не претерпевают дальнейшего изменения даже по истечении определенного периода времени. Однако это не значит, что отдельные частицы остаются неизменными». Г. И. Льюис и М. Рандэл, 1923 г. Как показывает практика, межпредметные связи в обучении являются конкретным выражением интеграционных процессов, происходящих сегодня в науке и в жизни общества. Эти связи играют важную роль в повышении практической и научно-теоретической подготовки учащихся, существенной особенностью которой является овладение школьниками обобщенным характером познавательной деятельности. Обобщенность же дает возможность применять знания и умения в конкретных ситуациях, при рассмотрении частных вопросов, как в учебной, так и во внеурочной деятельности, в будущей производственной, научной и общественной жизни выпускников средней школы. С помощью многосторонних межпредметных связей не только на качественно новом уровне решаются задачи обучения, развития и воспитания учащихся, но также закладывается фундамент для комплексного видения, подхода и решения сложных проблем реальной действительности. Именно поэтому межпредметные связи являются важным условием и результатом комплексного подхода в обучении и воспитании школьников. Часто при изучении темы: «Обратимые химические реакции. Химическое равновесие. Способы смещения химического равновесия, принцип Ле-Шателье.» не уделяется должного внимания химическому эксперименту. В то время как умелое использование химического эксперимента дает возможность содействовать повышению мотивации обучения, эффективному формированию качественных знаний, умений и навыков учащихся посредством представления учебного материала в интересной, визуализированной, интерактивной и максимально понятной для обучающихся форме. План конспект урока по теме: «Обратимые химические реакции. Химическое равновесие. Способы смещения химического равновесия. Принцип Ле Шателье.» ЦЕЛИ: -создать условия для изучения темы урока; - продолжать формирование понятий о типах химических реакций по признаку обратимости; - сформировать представления о химическом равновесии как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости; - рассмотреть значение темы в природе, жизни, химическом производстве; -дальнейшее развитие общеучебных и предметных умений (анализировать, сравнивать, делать выводы, составлять уравнения химических реакций, развивать логическое мышление и память, научный химический языка); -развивать умение осуществлять самостоятельную деятельность на уроке; -воспитывать культуру умственного труда. Содействовать повышению мотивации обучения, эффективному формированию качественных знаний, умений и навыков учащихся посредством представления учебного материала в интересной, визуализированной, интерактивной и максимально понятной для учащихся форме. Поддержать инновационную деятельность учащихся в использовании мультимедиа технологий в образовательном процессе. Актуализировать интеллектуальные и творческие способности суворовцев. Использование межпредметных связей с биологией, физикой, обществознанием. ЗАДАЧИ: Формирование предметных компетенций, основанных на знаниях, умениях и навыках в рамках раздела “Химическая реакция” при подготовке к ЕГЭ по химии. Формирование информационных компетенций, умение анализировать, сравнивать, делать выводы при выполнении химического эксперимента. Развитие коммуникативных способностей учащихся (сотрудничество, обмен мнениями при выполнении виртуальной лабораторной работы и компьютерных тестов) МЕТОД: беседа, самостоятельная работа суворовцев, демонстрации, лабораторный эксперимент. МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: средства ТСО, таблицы, дидактический материал, химические реактивы, химическое оборудование, мультимедиа презентация. Х о д у р о к а
ПЛАН: 1. Актуализация темы. Понятие о химическом равновесии, как и понятие о скорости химических реакций – химической кинетике, имеет большое значение для решения практических вопросов увеличения выхода продукта в химическом производстве, а так же в понимании многих физических и биологических процессов. 2. Так как тема первоначально изучалась в 9 классе, изучение идет по опорному конспекту. Задание суворовцам для самостоятельной работы. 1. Изучить текст параграфа и ответить на вопросы (самостоятельная работа с учебником): - Какие реакции называются обратимыми? - Почему обратимые реакции не доходят до конца, а достигнув определенного предела как бы прекращаются? 2. Изучите график «Достижение состояния химического равновесия» и дате определение химическому равновесию. (Что такое равновесие?) В чем особенность химического равновесия? 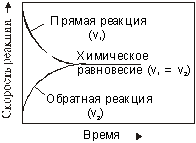 3. Химическое равновесие при неизменных условиях может сохраняться сколь угодно долго. Смещение химического равновесия, т. е. переход от одного равновесного состояния к другому подчинятся принципу динамического равновесия, который сформулировал французский ученый Ле Шателье и носит его имя. Обратитесь к тексту параграфа и сформулируйте принцип Ле Шателье (устный ответ). 4. Для выяснения влияния изменения внешних условий на смещение химического равновесия обращаемся к химическому эксперименту. I. Демонстрационный и лабораторный химический эксперимент по теме: «Обратимые химические реакции». 1. Демонстрационный опыт. (ВЛИЯНИЕ ИЗМЕНЕНИЯ ТЕМПЕРАТУРЫ)   2NO2 N2O4 + Q Смещение химического равновесия экзотермической реакции при 2NO2 N2O4 + Q Смещение химического равновесия экзотермической реакции припонижении температуры (видеофрагмент). 2. Демонстрационный опыт. Co(H2O)62+ + 4Cl- ↔ CoCl4 2- + 6H2O - Q розовый синий Смещение химического равновесия эндотермической реакции при повышении температуры (видеофрагмент). Суворовцы делают вывод о направлении смещения химического равновесия, результаты заносят в опорный конспект. II. Выполнение лабораторной работы по группам. ВЛИЯНИЕ ИЗМЕНИЯ ТЕПЕРАТУРЫ Группа №1 В водном растворе аммиака существует равновесие:   NH4ОН NH4+ + OH- + Q NH4ОН NH4+ + OH- + QМетодика эксперимента: в пробирку налить 2 - 3 мл дистиллированной воды и добавить 1 каплю концентрированного раствора аммиака. Прибавить 1 – 2 капли раствора фенолфталеина и нагреть. Наблюдается исчезновение окраски. Затем в стакане охладить колбу под водой - красное окрашивание появляется вновь. Почему при повышении t0 красное окрашивание исчезает, а при охлаждении появляется вновь? Группа №2 В пробирку налить 3 – 4 мл раствора крахмала и добавить 3 – 4 капли раствора йода до появления синей окраски. Нагреть пробирку. Что наблюдаете? Затем охладить пробирку под водой. Что наблюдаете? Определите тепловой эффект реакции:   йод + крахмал (бесцветный) йодкрахмал(синий) йод + крахмал (бесцветный) йодкрахмал(синий)Подведение итогов лабораторных опытов, оформление опорного конспекта. Дополнительный вопрос: 1. Как происходит терморегуляция организма при охлаждении и перегревании организма? ВЛИЯНИЕ ИЗМЕНИЯ КОНЦЕНТРАЦИИ Группа №3 В растворах, содержащих шестивалентный хром, существует равновесие:   2CrO42- + 2H+ Cr2O72- + H2O 2CrO42- + 2H+ Cr2O72- + H2Oхромат-ион дихромат-ион (желтый цвет) (оранжевый цвет) Изменение концентрации ионов водорода смещает это равновесие. Методика эксперимента: в химический стаканчик на 100 мл налить небольшое количество раствора хромата калия K2CrO4. К этому раствору по каплям добавить концентрированную серную кислоту. Когда раствор станет оранжевым, добавить по каплям концентрированный раствор щелочи, наблюдается появление желтой окраски. После этого можно снова прилить кислоту и получить оранжевую окраску. Каким образом изменение концентрации ионов водорода смещает равновесие? Группа №4   В реакции FeCl3 + 3KCNS Fe(CNS)3 + 3KCl В реакции FeCl3 + 3KCNS Fe(CNS)3 + 3KCl (желтый цвет) (красный цвет) (бесцветен) с   уществует равновесие Fe(CNS)3 Fe3+ + 3CNS-. уществует равновесие Fe(CNS)3 Fe3+ + 3CNS-. Всякое изменение концентрации Fe(CNS)3 сказывается на изменении окраски раствора. Это позволяет наблюдать в каком направлении сдвигается равновесие при изменении концентрации реагирующих веществ. Получен красный раствор Fe(CNS)3, в который добавили столько воды, чтобы окраска из кроваво-красной стала желтой. При добавлении воды диссоциация роданида железа (III) усиливается, наступает момент полной диссоциации, когда в растворе находятся ионы Fe3+ и CNS-, поэтому исчезает красная окраска, характерная для молекул Fe(CNS)3. Полученный раствор разлит Fe(CNS)3 в два стакана. В один стакан добавьте раствор FeCl3, в другой – KCNS. Что наблюдаете? Почему окраска раствора стала кроваво-красной? Группа №5 Просмотрев видеофрагмент на персональном ноутбуке «Влияние изменения концентрации на смещение химического равновесия», ответьте на вопрос: «Почему при добавлении KCl раствор меняет цвет с розового на синий?»   Co(H2O)62+ + 4Cl- CoCl42- + 6H2O Co(H2O)62+ + 4Cl- CoCl42- + 6H2Oрозовый синий Всякое изменение концентрации сказывается на изменении окраски раствора. Это позволяет наблюдать в каком направлении сдвигается равновесие при изменении концентрации реагирующих веществ. Подведение итогов лабораторных опытов, оформление опорного конспекта. Дополнительный вопрос: Механизм отравления угарным газом и первая помощь при отравлении. Hb•O2 + CO ↔ Hg•CO + O2 Кислород проходит через легкие и не поступает клеткам. Угарный газ может стать причиной отравления людей в боевой обстановке при нахождении в зоне горения огнеметно зажигательных средств, при мино – подрывных работах, при стрельбе из закрытых и полузакрытых помещений, при прогревании двигателей автомобильной и бронетанковой техники в зимних условиях в закрытых хранилищах, при нахождении в палатках и других помещениях, отапливаемых печами. Первая помощь – обеспечить доступ кислорода, уменьшить концентрацию угарного газа. Почему? III. Влияние изменения давления на смещение химического равновесия. Прочитав текст параграфа, ответить на вопрос. Как влияет повышение и понижение давления на смещение равновесия в реакции: N 2 + 3H2 ↔ 2NH3 + Q Устный ответ суворовца. Дополнительные вопросы: 1. Будет ли влиять изменение давления на смещение равновесия в реакции: N2 + O2 ↔ 2NO – Q ? 2. Будет ли катализатор влиять на смещение равновесия? 3. Посмотрев видео фрагмент, ответьте на вопрос «Почему изменилась окраска газа в реакции 2NO2 ↔ N2O4 бурый газ бесцветный газ Вопрос: Почему система при изменении внешнего воздействия смещает равновесие? Вывод. При изменении внешнего воздействия система смещает равновесие, так как стремится вернуться в состояние равновесия. IV. Сообщение с уворовца о научной деятельности ЛеШателье. Анри Луи ЛЕ ШАТЕЛЬЕ Henri Louis Le Chatelier, 1850–1936 Французский химик. Родился в городе Мирибель-лез-Эшель в семье ученых. Получил образование в престижной Парижской политехнической школе. Был профессором в Высшей горной школе и в Сорбонне, позже был назначен Генеральным инспектором шахт и рудников Франции (до него этот пост занимал его отец). Ле Шателье изучал химические реакции, связанные с несчастными случаями на шахтах и в металлургическом производстве, участвовал в исследовании детонации рудничного газа. Разработал термоэлектрический пирометр (оптический прибор для определения температуры раскаленных тел по цвету) и гидравлические тормоза для железнодорожных составов; изобрел кислородно-ацетиленовую сварку.  5. Установление межпредметных связей. А) С производством. Знание закономерностей протекания химических реакций позволяет управлять химическими реакциями. Располагая знаниями о химическом равновесии и применяя на практике принцип Ле Шателье, можно выбрать оптимальные условия для многих химических производств. Слайд – выбор оптимальных условий реакции синтеза аммиака (устные ответы суворовцев) Б) С физикой. Приведите примеры физических процессов, при которых устанавливается динамическое равновесие? 1.Равновесие между водой и водяным паром при постоянной температуре. В определенный промежуток времени испаряется столько же молекул воды, сколько конденсируется молекул пара. 2. Электронное облачко над поверхностью металла. 3. Равновесие в электролитах. 4. Видеофрагмент «Изменение температуры кипения воды при понижении давления» В) С биологией. Этот принцип универсален. Умение смещать равновесие очень важно для химических и физических процессов, но иногда оказывается не менее важным умение сохранять равновесие. Если равновесие будет нарушено, это приведет к катастрофическим последствиям для всего живого. При изучении данной темы всегда хочется привести пример стремления всего живого к равновесию, компенсации. Например: изменение численности популяции мыши -ореховый год-корма для мышей много, популяция мышей быстро растёт. С ростом численности мышей уменьшается количество пищи, в результате скопления грызунов начинается рост различных инфекционных заболеваний среди мышей, поэтому происходит постепенное уменьшение численности популяции грызунов. Через какой-то период времени наступает динамическое равновесие численности рождающихся и погибающих мышей, сдвиг этого равновесия может произойти в ту или другую сторону под влиянием внешних, благоприятных или неблагоприятных условий. Г) С экономикой. Принцип Ле Шателье прекрасно действует и в тех случаях, которые не имеют никакого отношения к химии. В нормально действующей экономике общая сумма находящихся в обращении денег находится в равновесии с теми товарами, которые можно на эти деньги купить. Что будет, если «внешним воздействием» окажется желание правительства напечатать денег побольше, чтобы рассчитаться с долгами? В строгом соответствии с принципом Ле Шателье, равновесие между товаром и деньгами будет смещаться таким образом, чтобы ослабить удовольствие граждан от обладания большим количеством денег. А именно, цены на товары и услуги вырастут, и таким путем будет достигнуто новое равновесие. Другой пример. В одном из городов США было решено избавиться от постоянных пробок путем расширения магистралей и строительства транспортных развязок. На некоторое время это помогло, но затем обрадованные жители начали покупать больше автомобилей, так что вскоре пробки возникли вновь, – но при новом «положении равновесия» между дорогами и бóльшим числом автомобилей. Д) Вопросы экологии. Биологическое разнообразие продолжает сокращаться, а экологическое равновесие все еще подвергается изменениям. Около 60% экологической системы деградирует или используется безрассудно, что ведет к потере биологического разнообразия и тяжелым последствиям, которые в ближайшие 50 лет могут усугубиться.  Африканский белый пеликан (исчезающий вид) Всемирный союз охраны природы выделяет семь основных факторов, способствующих потере биологического разнообразия: Утеря и фрагментация естественной среды; Конкуренция со стороны инвазивных видов; Загрязнение окружающей среды; Глобальные климатические изменения; Опустынивание; Рост населения и чрезмерное потребление; Безрассудное использование природных ресурсов. 6. Рефлексия. Тестирование. 7. Подведение итогов. Выставление оценок. Задание на самоподготовку. Ухлинова Л.Н. Опорный конспект по теме: «Обратимые химические реакции. Химическое равновесие. Способы смещения химического равновесия. Принцип Ле Шателье Брауна.»
ТАБЛИЦА
Задание на самоподготовку §16, упр. 5,6 |


 онижение температуры
онижение температуры  овышение температуры
овышение температуры