Конспект занятия Получение, свойства и применение алканов
 Скачать 57.7 Kb. Скачать 57.7 Kb.
|
| Конспект занятия Получение, свойства и применение алканов
Продолжаем изучение алканов по единому для всех классов органических веществ плану.
5. Получение. Предельные УВ можно получать в больших количествах (промышленные способы получения) и в небольших – для проведения различных опытов (лабораторные способы получения). Основные промышленные способы получения: 1) из природного сырья (нефти, природного и попутного нефтяного газов) с помощью ректификации. Ректификация (фракционная перегонка) – физический способ разделения смеси компонентов с различными температурами кипения. Газообразные алканы чаще получают из природного и попутного нефтяного газов, а твердые – из нефти. 2) газообразные и жидкие алканы находят более широкое применение в народном хозяйстве, чем твердые. Поэтому часть твердых (высших) алканов, получившихся в результате ректификации, используют для получения низших предельных УВ. Для этого их подвергают крекингу. Крекинг – разложение молекул высших углеводородов под действием высокой температуры примерно пополам. С10Н22 декан пентан пентен 3) При крекинге высших УВ, как мы видим, кроме предельных УВ образуются непредельные УВ. Из них также можно получить алканы с помощью реакции гидрирования. Гидрирование – присоединение водорода к молекулам непредельных УВ. С5Н10 + Н2 пентен пентан Основные лабораторные способы получения. 4) Синтез Вюрца. При взаимодействии галогеналканов с натрием образуются предельные УВ и галогенид натрия. 2СН3 – СН2Br + 2Na → CH3 – CH2 – CH2 – CH3 + 2NaBr бромэтан бутан бромид натрия Синтез Вюрца хорошо протекает только в том случае, когда атом галогена присоединен к первичному атому углерода. В результате этой реакции цепь атомов углерода увеличивается в два раза. Если натрием подействовать на смесь галогеналканов (например, бромэтан и бромметан), то в результате образуется смесь алканов (этан, пропан и бутан). 5) Гидролиз карбидов. При обработке некоторых карбидов, например, карбида алюминия, водой образуется метан. Al4C3 + 12 H2O → 4 Al(OH)3 + 3 CH4 6. Физические и химические свойства. С увеличением молекулярной массы в гомологическом ряду алканов их физические свойства последовательно изменяются: повышаются температуры кипения и плавления. Первые четыре члена ряда метана – газы, последующие (С5 – С15) – жидкости. Начиная с С16Н34, предельные УВ являются твердыми веществами. Газообразные и твердые алканы запаха не имеют, а жидкие - имеют характерный бензиновый запах. Отсутствие в молекулах предельных УВ полярных связей приводит к тому, что они плохо растворяются в воде, но растворяются в неполярных углеводородных растворителях (по принципу «подобное растворяется в подобном»). Кроме того, жидкие алканы сами являются органическими растворителями. Как уже говорилось, в молекулах алканов связи малополярны и очень прочны, поэтому они не могут вступать в реакции с заряженными частицами (ионами). Неполярные связи склонны к гомолитическому разрыву, поэтому наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов - реакции свободнорадикального замещения, в ходе которых атом водорода заменяется на атом галогена или какую-либо группу атомов. Кроме реакций замещения, для алканов характерны реакции отщепления, разрыва цепи и некоторые другие.
а) галогенирование – процесс замещения атомов водорода на атомы галогенов (хлор, бром, йод, фтор). Эти реакции проводятся под действием УФ-излучения или высокой температуры, и в их результате образуется смесь галогензамещенных алканов. Схематично хлорирование метана можно изобразить следующим образом: метан хлорметан CH3Cl + Cl2 хлорметан дихлорметан CH2Cl2 + Cl2 трихлорметан, хлороформ CHCl3 + Cl2 тетрахлорметан б) нитрование (реакция Коновалова) – процесс замещения атома водорода на нитрогруппу. СН4 + HNO3 нитрометан 2) реакции отщепления (также характерны для алканов) а) дегидрирование – отщепление от молекулы алкана молекулы водорода и получение непредельного УВ. СН3 – СН2 - СН3 пропан пропен б) ароматизация . Алканы с шестью и более атомами углерода в цепи в присутствии катализатора циклизуются с образованием бензола и его производных СН3 ׀ 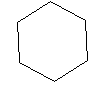  СН3СН2СН2СН2СН2СН2СН3 3) окисление а) горение (характерно для всех углеводородов)  СН4 + 2О2 → СО2↑ + 2Н2О СН4 + 2О2 → СО2↑ + 2Н2О2СН4 + 3О2 → 2СО↑ + 4Н2О при недостатке СН4 + О2 → С + 2Н2О кислорода б) каталитическое окисление. В зависимости от условий проведения реакции (температура, давление) и природы катализатора могут образовываться спирты, альдегиды или карбоновые кислоты.   СН4 СН4метан метанол Н ОН метаналь метановая, или уксусная кислота 4) разрушение цепи. В результате этих реакций происходит разрыв связей между атомами углерода или между атомами углерода и водорода. а) пиролиз – термическое разложение без доступа воздуха при пониженном давлении. СН4 б) крекинг С6Н14 → С3Н8 + С3Н6 в) изомеризация – процесс превращения углеводородов нормального (линейного) строения в разветвленные. СН3 – СН2 – СН2 – СН3 бутан ׀ СН3 2-метилпропан 7. Применение. Предельные УВ, в особенности метан, находят очень широкое применение в народном хозяйстве. Их применение связано с их свойствами. 1) Благодаря высокой теплоте сгорания алканы используют в качестве достаточно дешевого топлива в быту, в промышленности, как моторное топливо. 2) Получение спиртов, альдегидов, органических кислот, а далее из них – каучуков, синтетических моющих средств, синтетических жиров, смазочных материалов, лаков, эмалей и т.д. 3) Метан – источник водорода для синтеза аммиака, ацетилена – для газосварки, сажи – для резины и типографской краски. 4) Получение галогенпроизводных: - хлорметан – растворитель; - дихлорметан – используют как растворитель и в холодильной технике; - трихлорметан (хлороформ) – как растворитель, получение фреонов, тефлона, хлорофоса; - тетрахлорметан (четыреххлористый углерод) – как растворитель, получение фреона, гашение пламени, обезжиривающее средство; - хлорэтан – средство местной анестезии. |