«Классификация химических реакций. Окислительно-восстановительные реакции»
 Скачать 132.43 Kb. Скачать 132.43 Kb.
|
Тема: «Классификация химических реакций. Окислительно-восстановительные реакции» Цели: А) Повторить классификацию химических реакций по различным признакам, познакомить учащихся с новой классификацией по признаку изменения степени окисления элементов, образующих реагирующие вещества и продукты реакции, - сформировать понятия: «окислительно-восстановительная реакция, «окислитель», «восстановитель», «окисление», «восстановление»: Б) Начать формирование умений по расстановке коэффициентов методом электронного баланса, продолжить формирование навыков по проведению опытов, повторить правила техники безопасности при работе с реактивами. В) Осуществить экологическое воспитание учащихся на примере влияния окислительно-восстановительных реакций на окружающую среду, воспитание бережного отношения к школьному оборудованию. Планируемые результаты обучения: А) обучающиеся должны знать классификацию химических реакций по различным признакам; определения понятий: окислительно-восстановительная реакция, окислитель, восстановитель, окисление, восстановление; Б) уметь определять окислительно-восстановительную реакцию, прогнозировать окислительно-восстановительные свойства на примере различных элементов; В) уметь расставлять коэффициенты методом электронного баланса; Г) знать о роли окислительно-восстановительных реакций в круговороте веществ, влиянии на экологическую обстановку. Тип урока: урок изучения нового материала Методы: демонстрация таблиц, опытов, демонстрация электронных презентаций, химический диктант, самостоятельная работа учащихся со справочными материалами, работа с учебником, лабораторные опыты с элементами проблемного обучения. Средства обучения: таблица «Растворимость кислот, солей, оснований», ПСХЭ Д.И.Менделеева, таблицы «Типы химических реакций», «Степень окисления», дидактические материалы по теме «Окислительно-восстановительные реакции», карточки для химического диктанта, химическая копилка, электронный диск с презентацией, тесты, учебно-электронное пособие по курсу «Биотехнология». Реактивы на столе учащихся: растворы медного купороса, гидроксида натрия, железные скрепки или гвозди. Хронокарта урока: I. Организационный момент – 1 мин. II. Мотивация урока – 2 мин. III. Контроль исходного уровня – 5 мин. IY. Изучение нового материала – 20 мин. Y. Обобщение – 5 мин. YI. Закрепление нового материала – 5 мин. YII. Домашнее задание – 2 мин. Ход урока: I. Организационный момент Учитель проверяет готовность класса к занятию. Акцентирует внимание на то, что нельзя трогать руками реактивы, стоящие на столах без разрешения учителя. II. Мотивация урока Эпиграф: «Есть просто газ мельчайший – водород , Есть просто кислород, а вместе это – Июньский дождь от всех своих щедрот, Сентябрьские туманы на рассветах……» Учитель: О каких превращениях, происходящих в природе, идет речь? ( о химических реакциях) Вспомните, какой самый отличительный признак определяет химическое явление или химическую реакцию? (образование новых веществ, отличающихся от старых свойствами, строением, составом) Давайте повторим признаки, а поэтому и разные классификации химических реакций, которые мы уже изучили. Для этого поработаем с нашей химической копилкой. III. Контроль исходного уровня Учащийся выступает в роли хранителя химической лаборатории и проводит химический диктант: В карточках с определениями типов химических реакций даны только формулировки понятий, необходимо записать в тетради ответы в виде типов химических реакций (задания хранятся в виде карточек в химической копилке) см. Приложение № 1. Затем идет взаимопроверка: ученики обмениваются тетрадями, ставят себе оценки. Итог: работа с таблицей у доски «Классификация химических реакций» - по числу и составу реагирующих и образующихся веществ: а) соединения, б) разложения, в) замещения, г) обмена - по агрегатному состоянию веществ (фазе): а) гомогенные, б) гетерогенные - по тепловому эффекту: а) экзотермические, б) эндотермические - по использованию катализатора: а) каталитические, б) некаталитические - по обратимости: а) обратимые, б) необратимые IY. Изучение нового материала 1. Актуализация знаний. Учитель предлагает проделать два лабораторных опыта (внимание, техника безопасности). А) раствор сульфата меди (II) с гидроксидом натрия CuSO4 + 2NaOH = Na2SO4 + Cu (OH) 2 Б) раствор сульфата меди (II) с железными гвоздями или скрепками (опыт заложить заранее) CuSO4 + Fe = Cu + FeSO4 Затем учитель предлагает в каждом уравнении расставить степень окисления каждого элемента исходных веществ и продуктов реакции. Учитель предлагает сравнить обе реакции и найти отличие по степени окисления элементов. Учащиеся показывают, что в первом случае степени окисления элементов не изменились, а во втором случае изменилась у меди и железа. (Работа с приложением № 3) Учитель сообщает: «Такие реакции, в результате которых изменяются степени окисления элементов, образующих реагирующие вещества, называются окислительно-восстановительными реакциями (ОВР). Учащиеся записывают тему урока в тетради. Учитель предлагает разобраться, что же произошло с элементами, изменившими степень окисления:  Cu+2 + 2e Cu0 окислитель, восстановление Cu+2 + 2e Cu0 окислитель, восстановление Fe0 - 2e Fe+2 восстановитель, окисление Fe0 - 2e Fe+2 восстановитель, окислениеИз записи видно, что оба процесса: отдачи электронов – процесс окисления и процесс восстановления тесно взаимосвязаны.
(Самостоятельная работа учащихся с алгоритмом прогнозирования окислительно-восстановительных свойств соединений) Приложение № 2 Вставить недостающие знаки: _ С 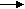 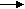 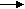   l2 2CL , Cr0 Cr+3 , 2O-2 O2 , Fe +2 Fe+3 , S -2 S+6 l2 2CL , Cr0 Cr+3 , 2O-2 O2 , Fe +2 Fe+3 , S -2 S+6
Учитель: Используя алгоритм по расстановке коэффициентов в окислительно-восстановительных реакциях методом электронного баланса, расставьте коэффициенты. (Смотреть приложение № 4) Задание № 1 Порошок серы защищает виноградную лозу и зреющий виноград от вредителей и болезней на плантациях, а хранение нежных гроздьев винограда осуществляют в атмосфере, содержащей оксид серы (II). При этом происходят следующие реакции: S + O2 = SO2 H2S + O2 = S + H2O Задание №2 Ниже приведены уравнения реакций получения фумигаторов (веществ, истребляющих насекомых и микроорганизмы при перевозке и хранении сельскохозяйственных продуктов), укажите окислительно-восстановительные процессы. CH4 + Cl2 = CCl4 + HCl 4. Значение окислительно-восстановительных реакций А) Литературная гостиная: (два ученика читают стихотворения и рассказывают об окислительно-восстановительных реакциях, происходящих в окружающей среде) 1 ученик: …На рукомойнике моем позеленела медь. Но так играет луч на нем, что весело глядеть… (А.Ахматова из сборника «Вечер») Медь взаимодействует сначала с кислородом, а затем продукты реакции взаимодействуют с углекислым газом и с водой, постепенно превращаясь в основной карбонат меди – малахит: 2Cu + O2 =2 CuO 2CuO + CO2 + H2O = (CuOH)2CO3 (малахит) …От медленных лобзаний влаги Нежнеет грубый свод гробниц, Где зеленеют саркофаги Святых монахов и девиц…… ( А.Блок Итальянские стихи ) 2 ученик …Трясся Крым двадцать восьмого года, И восстало море на дыбы, Испуская к ужасу народа, Огненные серные столбы. Все прошло. Опять гуляет пена, Но с тех пор все выше и плотней Сумрачная серная гиена Подступает к днищам кораблей….. (Ю. Кузнецов, Тайна черного моря) Сероводород постоянно образуется на дне черного моря при взаимодействии растворенных в морской воде сульфатов с органическими веществами. Этот процесс связан с жизнедеятельностью сульфатвосстанавливающих микроорганизмов. До верхних слоев воды сероводород не доходит, так как на глубине 150 м он встречается с проникающим сверху кислородом. На этой же глубине обитают серобактерии, которые способствуют окислению сероводорода до серы: 2  Н2S + O2 = 2H2O + 2S Н2S + O2 = 2H2O + 2SБ) Показ слайдов из учебного электронного издания по курсу «Биогеотехнология» Объяснение учащегося: Окислительно-восстановительные реакции широко используются для получения металлов из руд. Например биогидрометаллургия – это наука о получении металлов с помощью микроорганизмов. Это современное направление в химической промышленности. Огромное количество бактерий может окислять неорганические субстраты (минеральные горные породы) и получать при этом энергию. Такими способами можно выделять из руд железо, цинк и другие цветные металлы. Окисление цинка бактериями прямой окислительный процесс, при этом окисляются сульфидные минералы с образованием сернокислого цинка. Активность бактериального выщелачивания цинка из сульфидных минералов возрастает в присутствии минерала пирита и трехвалентного железа. Бактерии окисляют сульфиды цинка прямым окислением, то есть независимо от присутствия железа. С  хема окисления: ZnS + 2O2 ZnSO4 хема окисления: ZnS + 2O2 ZnSO4 Бактериальное окисление – это совокупность реакций окисления, осуществляемых бактериями. Три четверти запасов золота сосредоточено в виде вкраплений внутри кристаллических решеток сульфидных минералов. Для извлечения золота окисляют сульфидные минералы, разрушая их кристаллические решетки. Y. Обобщение (Демонстрация презентации по теме «Окислительно-восстановительные реакции»). YI. Закрепление нового материала: 1.Самостоятельная работа учащихся: Игра «Кто лишний?» А) Выберите из предложенных реакций уравнения окислительно-восстановительных реакций. Б) К какому типу относятся другие реакции. В) Дайте характеристику реакциям по числу и составу исходных веществ и образующихся в результате реакции. (См. Приложение № 5) YII. Домашнее задание. Параграф 43, упр. 1, упр. 7 индивидуально для сильных учащихся. Приложение № 1 Задания химической копилки
Приложение №2 Алгоритм прогнозирования окислительно-восстановительных свойств соединений
Справка

Приложение № 3 Алгоритм определения типа химической реакции по изменению степеней окисления элемента
Cправка Реакции, проходящие с изменением степеней окисления элементов, - окислительно-восстановительные. Приложение № 4 Алгоритм расстановки коэффициентов в уравнениях окислительно-восстановительных реакций методом электронного баланса
(число атомов каждого элемента каждого химического элемента в его правой и левой частях одинаково). Справка Восстановитель - вещество, в состав которого входит элемент, повышающий степень окисления. Окислитель – вещество, в состав которого входит элемент, понижающий степень окисления. Восстановитель – окисляется. Окислитель – восстанавливается. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Метод электронного баланса Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Приложение № 5 Игра «Кто лишний? Найти уравнения окислительно-восстановительных реакций»
|