Основы химического анализа
 Скачать 343.91 Kb. Скачать 343.91 Kb.
|
Макро-, микро- и полумикрометоды химического анализа В зависимости от массы исследуемого вещества, объема взя того для анализа раствора и техники выполнения отдельных опера ций различают макро-, микро- и полумикрометоды анализа. Для выполнения анализа макрометодом требуется 20-30 мл раствора, содержащего 1-10 г исследуемого вещества. Отдельные реакции выполняют в обычных пробирках, химических стаканах или колбах; образующиеся осадки отделяют фильтрованием через бумажные или пористые стеклянные фильтры. Для проведения микроанализа необходимо в 103-107 раз меньше исследуемого вещества, чем при макроанализе. Применяе мая посуда и приборы имеют небольшие размеры, а в некоторых случаях — специальную конструкцию. Количественное определение вещества осуществляют с помощью инструментальных методов, а отдельные реакции выполняют капельным или микрокристаллоскопическим способами. В капельном анализе обычно применяются реакции, сопро вождающиеся изменением окраски раствора или образованием цветных осадков. Их проводят на полосках фильтровальной бумаги или на специальной фарфоровой пластинке с углублениями. Микрокристаллоскопические реакции выполняют на пред метном стекле. О присутствии соответствующих элементов или ионов судят по форме образующихся кристаллов, рассматривая их под микроскопом. Основоположниками микрокристаллоскопического анализа являются выдающиеся русские ученые М. В. Ломо носов и Т. Е. Ловиц. Полумикроанализ занимает промежуточное положение меж ду макро- и микроанализом. Для его проведения требуется 1-10 мл раствора, содержащего 50-500 мг исследуемого вещества. Все опе рации осуществляют при помощи специальных приемов и аппара туры уменьшенных размеров. Например, реакции осаждения выполняют в маленьких конических пробирках емкостью 2-4 мл, в суженном кончике которых легко можно рассмотреть малое коли чество осадка. Для отделения осадка от жидкости используют цен трифугирование. Анализ веществ микро- или полумикрометодом имеет ряд преимуществ. Расход реагентов уменьшается во много раз. Воздух лабораторного помещения не так сильно загрязняется вредными газами и парами. В специальных случаях, например при исследовании высоко токсичных соединений, применяется ультрамикрометод химиче ского анализа, позволяющий работать с еще меньшими массами веществ, чем при микроанализе. Практическое задание: в ходе лекции заполнить опорный конспект занятия Схема Предмет, содержание и задачи аналитической химии. Химические, химико-физические и физические методы анализа. Обнаружение ионов капельным методом Аналитическая химия - Количественный анализ - Качественный анализ - Значение Методы анализа Методы анализа в зависимости от массы или объема Занятие 2 Аппаратура и посуда. Техника выполнения отдельных операций. Нагревание и выпаривание, осаждение, промывание и растворение осадков 2 часа Практическое задание:
Занятие 3 Растворы. Равновесие в водных растворах 1 час Все вещества в большей или меньшей степени растворимы в воде. Каждое из них характеризуется определенной растворимостью. Под растворимостью понимают максимальное количество вещества, которое способно раствориться при данной температуре в определенном коли честве растворителя. Раствор называют насыщенным, если растворенное в нем вещество содержится в количестве, равном растворимости этого вещества при данной температуре. Раствор, содержащий растворенное вещество в меньшем количестве, чем его растворимость, называется ненасыщен ным. Раствор называют пересыщенным, если он содержит растворен ного вещества больше, чем его растворимость при данной температуре. В ненасыщенном растворе данного вещества можно растворить еще некоторое количество того же вещества. Растворение будет про должаться до тех пор, пока раствор не станет насыщенным. В насы щенном растворе нельзя увеличить количество растворенного вещества, не изменяя внешних условий (температуры, объема и давления). Поэтому, если в насыщенный раствор какого-либо вещества внести еще некоторое количество его в твердом виде, оно больше не раство рится и наряду с раствором здесь будет присутствовать осадок. Раствор остается пересыщенным до тех пор, пока не образуется осадок. Если в пересыщенный раствор бросить кристаллик того ве щества, которое в нем растворено, тотчас вокруг него начнут расти новые кристаллы, и выпадение кристаллов будет продолжаться до тех пор, пока раствор не станет насыщенным. Вызвать кристаллизацию пересыщенного раствора можно также встряхиванием его или трением стеклянной палочки о внутренние стенки сосуда с раствором. Итак, если в сосуде с раствором присутствуют одновременно и растворенное вещество и осадок, раствор может быть только насыщенным. В ненасыщенном растворе осадок растворяется, а пересыщенный раствор неустойчив; в нем рано или поздно выпадает осадок растворяется, и сам он станет насыщенным. Растворимость вещества принято выражать в граммах растворен ного вещества на 100 г воды или в молях на 1 л раствора. Например: а) растворимость КCl 34,0 г при 20° означает, что в 100 г воды при 20° максимально растворяется 34 г KCl, т. е. в 134 г насыщенного раствора содержится 34 г KСl и 100 г H2О; б) растворимость Na2S04- ЮН.20 0,5 моль при 20° означает, что 1 л насыщенного раствора содержит 0,5 моль (161,1 г) Na2S04- 10Н2О. Кроме того, в практике пользуются следующими характеристиками растворов: разбавленный раствор — раствор, в котором содержание растворен ного вещества мало по сравнению с содержанием растворителя и далеко до насыщения; концентрированный раствор — раствор с высоким содержанием растворенного вещества. Концентрацией раствора называют количество вещества, содержа щегося в определенном весовом количестве раствора или растворителя (весовая концентрация) или в определенном объеме раствора (объемная концентрация). В качестве единицы объема в аналитической химии принят литр (л) или его тысячная часть — миллилитр (мл), в качестве единицы мас сы — грамм (г) или миллиграмм (1 мг=0,001 г). Пользуются также специальными химическими единицами массы: грамм-молекулой (моль) и грамм-эквивалентом (г-экв). Вычисляя концентрацию раствора, количество растворенного ве щества выражают в различных единицах: в граммах (на определенное количество растворителя или раствора), в процентах, грамм-молеку лах (молях), грамм-эквивалентах 1. Выразить концентрацию в процентах — значит указать, какое количество единиц массы растворенного вещества содержится в 100 еди ницах массы раствора. Например, если концентрация раствора КС1 равна 10%, это значит, что в 100 единицах массы (допустим в 100 г) этого раствора содержится 10 единиц массы (10 г) хлорида калия и 90 единиц массы (90 г) воды. Концентрацию, выраженную числом молей растворенного вещества на 1 л раствора, называют молярностью раствора. Различают растворы одномолярные (1 М), двумолярные (2 М), полумолярные (0,5 М), децимолярные (0,1 М), сантимолярные (0,01 М) и т. д. Концентрацию, выраженную числом грамм-эквивалентов растворенного вещества на 1 л раствора, называют нормальностью раствора. Грамм-эквивалент обозначается через Э. Так, т. е. грамм-эквивалент серной кислоты равен половине грамм- молекулы. Различают растворы однонормальные (1 н.), двунормальные (2 н.), полунормальные (0,5 н.), децинормальные (0,1 н.), сантинормальные (0,01 н.) и т. д. Иногда концентрацию раствора выражают через его плотность, так как определенной плотности раствора при данной температуре соответствует определенное содержание вещества в нем. Например, раствор серной кислоты плотностью 1,835 при 20° содержит 95,72% H2S04. Для определения концентрации раствора по его плотности пользуются справочными таблицами. Зная плотность рас твора, находят по справочнику процентное содержание вещества в нем, вычисляют молярность и нормальность раствора.  Практическое задание   Занятие 4 Гидролиз 2 часа Для водных растворов многих солей характерна кислая или щелоч ная реакция. Как известно, кислотность или щелочность раствора в водной среде зависит от избытка в растворе ионов водорода или гидроксила. В нейтральной среде концентрация каждого из этих ионов равна 10-7 г-ион/л. Избыток ионов Н+ или ОН- в растворе соли объясняется взаимодействием ионов соли с водой, например: Реакция соединения ионов соли с ионами водорода или гидроксила во ды называется гидролизом соли. Рассмотрим отношение к гидролизу солей четырех типов. 1. Соль образована сильным основанием и слабой кислотой. В ре зультате гидролиза такой соли в растворе находятся сильнодиссоциированное основание и слабодиссоциированная кислота. Следовательно, образуется больше ионов ОН-, чем ионов Н+, и раствор имеет щелоч ную реакцию (рН>7). Например, для водного раствора ацетата нат рия характерна щелочная реакция: Образуется слабодиссоциирующая уксусная кислота и сильнодиссоциирующий едкий натр. 2. Соль образована слабым основанием и сильной кислотой. В ре зультате гидролиза такой соли образуются слабое основание и силь ная кислота. Следовательно, в растворе будет больше ионов Н+, чем ОН-, и раствор приобретает кислую реакцию (рН<7). Например, раствор хлорида аммония имеет кислую реакцию: В растворе NH4C1 образуются слабодиссоциирующая гидроокись аммония NH4OH и сильнодиссоциирующая соляная кислота, поэтому реакция раствора кислая. 3. Соль образована слабым основанием и слабой кислотой. Продук ты гидролиза такой соли — слабая кислота и слабое основание. При этом в зависимости от степени диссоциации продуктов гидролиза (кислоты или основания) в растворе преобладают ионы Н+ или ОН-, и реакция соответственно слабокислая, слабощелочная или нейтраль ная. Например, у водного раствора карбоната аммония слабощелоч ная реакция: В растворе образуется гидроокись аммония, степень диссоциации которой больше, чем степень диссоциации HCO3-. Ацетат аммония в результате гидролиза образует уксусную кислоту и гидроокись аммония, степень диссоциа ции которых одинакова; среда нейтральная. 4. Соль образована сильным основанием и сильной кислотой. Гид ролиз этой соли, например NaCl, можно было бы представить уравне нием: Произведя сокращения в ионном уравнении, получим: Из уравнения видно, что ионы соли практически в реакции не участ вуют, и среда остается нейтральной. Следовательно, соль, образован ная сильным основанием и сильной кислотой, не подвергается гидролизу, и рН ее раствора равен 7. Мы рассмотрели гидролиз солей одноосновных кислот и одновалент ных катионов, когда продуктами гидролиза являются основания и кислоты. В случае соли, содержащей катион сильного основания и анион многоосновной слабой кислоты, например Na2CO:j, Na3P04, а также соли, содержащей анион сильной кислоты и многовалентный катион слабого основания, например MgCl2, A12(S04)3, гидролиз ус ложняется. Например, гидролиз Na2C03 может быть изображен в виде схем: 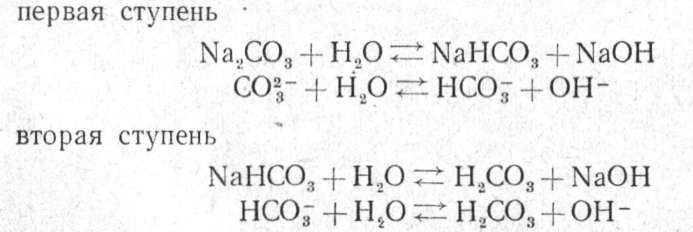 Гидролиз по первой ступени идет в значительно большей степени, чем по второй. Гидролиз солей трехосновных слабых кислот, например Na3P04, протекает по трем ступеням: 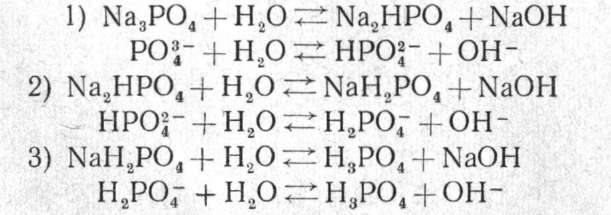 Гидролиз по первой ступени происходит в значительно большей степени, чем по второй, а по второй — больше, чем по третьей. Таким образом, продуктом гидролиза соли двух- и более основной слабой кислоты является кислая соль. Подобно этому при гидролизе двух- и более кислотного слабого основания образуется основная соль — соединение, содержащее, наряду с ионом металла и кислот ного остатка, ион ОН-, характерный для основания. Например, гидро лиз MgCl2 проходит по схеме: MgCl2 + Н20 ↔ MgOHCl + НС1 Mg2+ +С1- + Н2О↔ MgOHCl + Н+ Гидролиз Al(CH3COO)3, протекает по трем ступеням:
Практическое задание Какую реакцию среды имеет водный раствор соли: KCl, K2CO3, (NH4)2CO3, (NH4)2C2O4 Занятие 5 Классификация катионов и анионов 2 часа Форма занятия: лекция В качественном химическом анализе преимущественно имеют дело с водными растворами электролитов, поэтому аналитическими реакциями открывают образующиеся при диссоциации катионы и анионы. В форме катионов существуют элементы различных групп периодической системы (I A, I B, II А, III В, III A, IV A, VIII), поэтому и аналитические свойства катионов различны. Однако с помощью групповых реактивов из общей смеси катионов можно выделить отдельные группы катионов со сходными аналитическими свойствами – аналитические группы. Групповые реактивы могут быть осадителями, избирательно осаждающими катионы определенной группы в виде различных соединений (карбонатов, сульфидов, хлоридов, сульфатов, фосфатов, гидроксидов и др.), или реагентами, селективно выделяющими из смеси труднорастворимых веществ группу растворимых соединений (растворимых комплексов и амфотерных гидроксидов и т. д.). Применение разнообразных групповых реактивов позволило разработать различные аналитические классификации катионов (и анионов). Наибольшее распространение получили сульфидная, кислотно-основная и аммиачно-фосфатная классификации. Сульфидная классификация, предложенная еще Н. А. Меншуткиным, основана на различной растворимости сульфидов, карбонатов и хлоридов. По этой классификации все катионы делят на пять аналитических групп. Сероводородный метод анализа, основанный на сульфидной классификации, имеет два основных недостатка: токсичность сероводорода требует специально оборудованных химических лабораторий; выполнение анализа отнимает много времени. Таблица 1 Сульфидная классификация катионов
Кислотно-основная классификация основана на различной растворимости гидроксидов, хлоридов, сульфатов. Групповыми реактивами этого метода являются растворы кислот и оснований. По кислотно-основной классификации катионы делят на шесть аналитических групп (табл. 2). | ||||||||||||||||||||||||||||||||||||||||||||