Основы химического анализа
 Скачать 343.91 Kb. Скачать 343.91 Kb.
|
Таблица 2 Кислотно-основная классификация катионов
Выполнение анализа по кислотно-основной схеме имеет определенные преимущества:
Недостатком этой классификации является некоторая нечеткость в разделении катионов на аналитические группы. Так, ионы Рb2+, относящиеся к I группе, осаждаются групповым реактивом в виде РbС12 не полностью вследствие его значительной растворимости. Поэтому эти ионы частично переходят во II группу и осаждаются в виде PbSO4. Некоторые операции этого метода достаточно трудоемки, например перевод сульфатов BaSO4, SrSO4, CaSO4 в соответствующие карбонаты. Кислотно-основный метод (как и сероводородный) значительно осложняется присутствием РО43– –иона, поэтому при наличии этого иона приобретает определенные преимущества аммиачно-фосфатный метод. Существует несколько различных способов классификации анионов на аналитические группы. Общепринятого разделения анионов на группы не существует. Наиболее широко применяется классификация анионов, основанная на их способности образовывать малорастворимые соли бария и серебра. Групповыми реагентами в этом случае являются растворы ВаС12 и AgN03.В основу классификации анионов легло образование нерастворимых в воде осадков солей бария и серебра, окислительно-восстановительные свойства, способность образовывать газообразные вещества и др. Все анионы делятся на три аналитические группы (таблица 3). I группа анионов - соли бария, нерастворимые в воде. Групповым реагентом является хлорид бария, имеющий нейтральную или слабощелочную реакцию. Ко II группе анионов относятся ионы, образующие малорастворимые соли серебра. Групповой реагент - AgNO3. К III группе относятся анионы, соли серебра и бария которых растворимы в воде. Таблица 3 Классификация анионов
Занятие 6-8 Анализ КАТИОНов 3 часа Форма занятия: практическая работа по методическому пособию Качественный химический анализ катионов: методические указания к выполнению лабораторных работ / Сост. К.И.Яковлев, Л.Б.Сельдерханова, Е.С.Дмитриева – СПб. : Изд-во СПХФА, 2009 – 84 с. Занятие 9-10 Анионы аналитических групп 2 часа Форма занятия: практическая работа по методическому пособию Алексеева Г. М. Анализ анионов: Методические указания к выполнению лабораторных работ. — СПб.: Изд-во СПХФА, 2002. — 32 с. Занятие 11 Гравиметрический анализ 1 час Весовой анализ основан на том, что определяемую составную часть образца выделяют из раствора в виде осадка известного химиче ского состава. Зная массу полученного осадка, вычисляют количество данной составной части. Часто осадок перед взвешиванием прокаливают, чтобы разложить и превратить его в вещество другого состава, которое почему-либо удобнее взвешивать. Например, количество железа в растворах солей определяют, осаждая ионы Fe3+ раствором аммиака. При прока ливании полученная гидроокись железа теряет воду и превращается в окисел Fe2О3 который и взвешивают. Вследствие этого в весовом анализе различают две формы вещества: осаждаемую и весовую. Так, Fe(OH)3 — осаждаемая форма, Fe2О3 — весовая. Иногда осаждае мая и весовая формы — одно и то же соединение. Например, ион Ba2+ осаждают из раствора серной кислотой в форме BaSО4 и взвеши вают также в форме BaS04. При прокаливании его химический состав не меняется. Однако в большинстве случаев химический состав осаждаемой и весовой форм различен. Вещества в осаждаемой и весовой формах должны отвечать различ ным требованиям. Вещество в осаждаемой форме должно:
Вещество в весовой форме должно:
Перечисленные требования определяют подбор химических соеди нений для осаждаемой и весовой форм, а также условия их осаждения. Практическая работа Навеску взвешивают на аналитических весах с точностью до 0,2 мг (0,0002 г). Сначала взвешивают часовое стекло диаметром 4—6 см и записывают его массу. Затем насыпают шпателем на стекло вещество и вновь взвешивают. Иногда навеску удобнее взять по разности. В бюкс помещают анализируемое вещество и взвешивают его с крышкой на аналитических весах с точностью до 0,0002 г. Выни мают бюкс из шкафа весов (руки должны быть чистыми). Над стаканом, в котором проводится анализ, снимают левой рукой крышку с бюкса, ссыпают в стакан некоторое количество вещества и снова взвешивают бюкс с крышкой. Разность между результатами обоих взвешивании дает величину взятой навески. Занятие 12 Титрометрический анализ 1 час В весовом анализе определяемую составную часть растворенного образца переводят в осадок известного состава и по массе осадка вы числяют количество этой составной части. В объемном анализе основ ной операцией является измерение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а у вто рого заранее известна концентрация. Неизвестную концентрацию ана лизируемого раствора определяют, зная соотношение объемов реаги рующих растворов и концентрацию одного из них. Раствор, концент рация которого известна и при помощи которого определяют количе ство другого вещества, называется рабочим раствором. Допустим, требуется определить процентное содержание хлора в хлориде натрия. Это можно сделать одним из двух методов анализа: весовым или объемным. При весовом методе навеску анализируемого вещества растворяют в воде и количественно осаждают хлорид-ионы в виде AgCl. Добавляют избыток осадителя (разбавленный раствор AgNО3), концентрация которого может быть неизвестна. Определив массу осадка AgCl, вычисляют количество хлора в анализируемой пробе. Для объемного определения хлора в хлориде натрия необходимо применить раствор AgNО3 известной концентрации и точно определить объем раствора нитрата серебра, эквивалентный анализируемому количеству хлорида натрия. Эквивалентный объем определяют, титруя раствор NaCl раствором AgNO3. При объемном анализе необходимы следующие условия:
Практическая работа ПРИГОТОВЛЕНИЕ ТИТРОВАННОГО РАСТВОРА ИЗ ФИКСАИАЛА Фиксаналы — это изготовляемые в заводских или лаборатор ных условиях стеклянные ампулы, содержащие определенное коли чество грамм-эквивалентов х. ч. вещества в сухом виде или в раст воре. Чаще всего ампула содержит 0,1 или 0,01 г-экв вещества. Большинство фиксаналов хорошо сохраняется, однако некоторые из них с течением времени изменяются. Так, растворы едких щелочей по исте чении 2—3 месяцев мутнеют вследствие взаимодействия щелочи со стеклом ампулы. Чтобы приготовить раствор из фиксанала, содержимое ампулы количественно переносят в мерную колбу, разбавляют дистилли рованной водой, доводя объем до метки. Делают это следующим об разом. Находящиеся в коробке с фиксаналом бойки обмывают сначала водопроводной, а потом дистиллированной водой. Один боек встав ляют (рисунок 1) 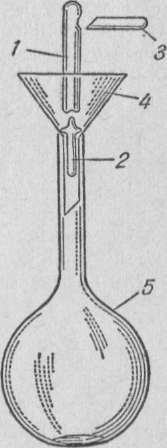 Рисунок 1 Прибор для приготовле ния раствора из фиксанала: 1 — ампула; 2, 3 — бойки; 4 — воронка; 5 — мер ная колба в чистую химическую воронку 3 таким образом, чтобы длинный конец бойка вошел в трубку воронки, а короткий (острый) конец его был направ лен кверху; крестовидное утолщение его упирается в нижнюю часть конуса воронки. Воронку вместе с бойком вставляют в чистую мерную колбу 5. Ампулу 1 обмывают сначала теплой, а затем холодной дистил лированной водой, чтобы смыть этикетку и загряз нения на ампуле. Хорошо вымытую с внешней сто роны ампулу переворачивают дном книзу. Ударяя ее нижним углублением по бойку в воронке, разбивают дно ампулы. Не изменяя положения ампулы над во ронкой, вторым бойком 2 пробивают верхнее углубле ние на ней. Содержимое ампулы выливается (или вы сыпается) в мерную колбу. Ампулу продолжают дер жать в том же положении. В образовавшееся верхнее отверстие вставляют оттянутый в капилляр конец трубки промывалки. Сильной струей из нее промывают ампулу изнутри. Струей воды из промывалки хорошо промывают наружную поверхность ампулы и воронку с бойком, после чего воронку вынимают из колбы. Уровень жидкости в колбе доводят до метки. Колбу плотно закрывают пробкой и тщательно перемешива ют раствор. Занятие 13 Подведение итогов. Конференция Приложение К занятию 2 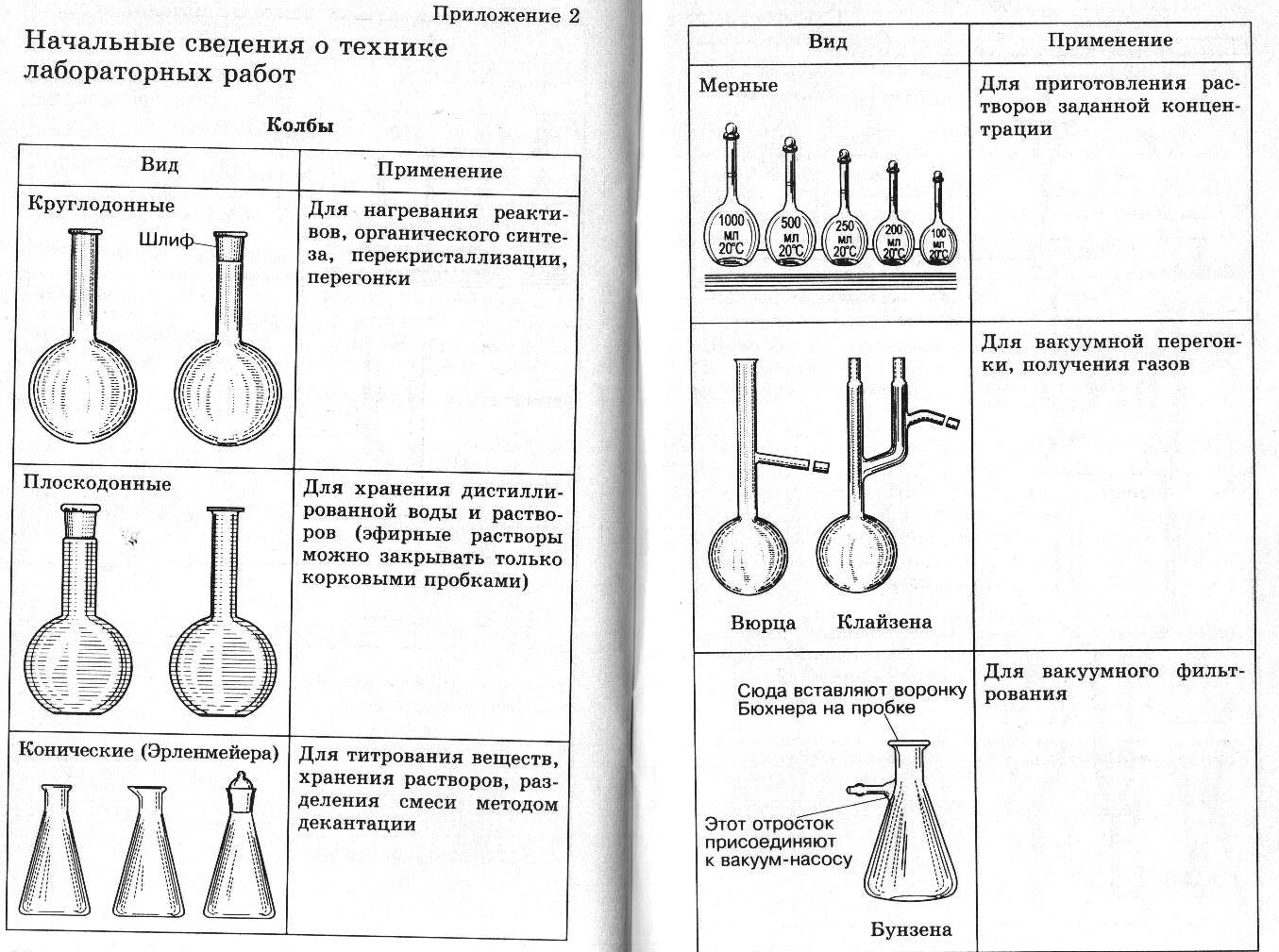 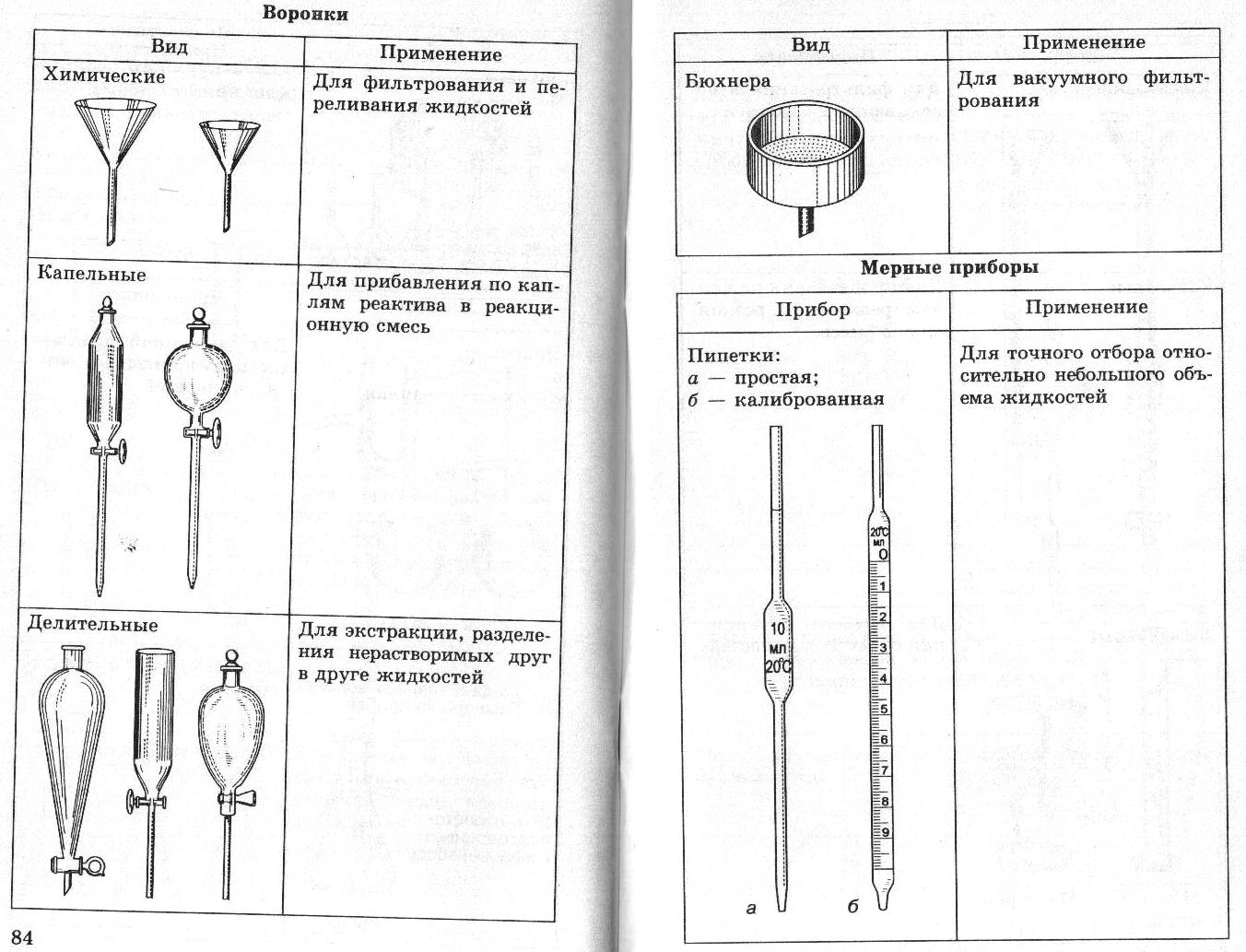 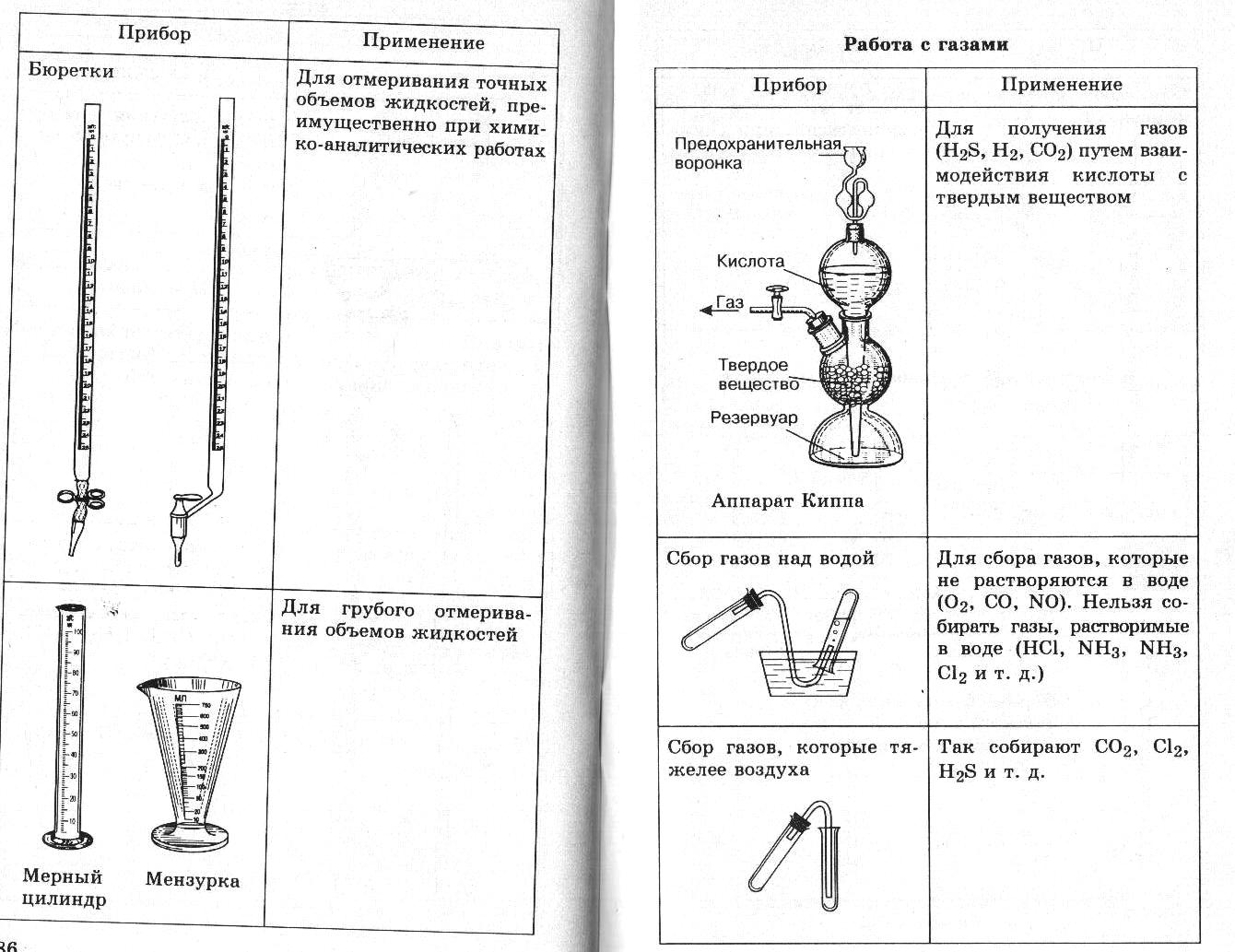 Техника выполнения аналитических операций 1 |