Рабочая программа основного общего образования по химии 8 9 класс Учитель химии 1 кв категории
 Скачать 394.82 Kb. Скачать 394.82 Kb.
|
В результате изучения химии ученик должензнать / понимать
уметь
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
Тема 1. Первоначальные химические понятия (18 ч) Предмет химии. Химия как часть естествознания. Вещества и их свойства. Чистые вещества и смеси. Способы очистки веществ: отстаивание, фильтрование, выпаривание, кристаллизация, дистилляция, хроматография. Физические и химические явления. Химические реакции. Признаки химических реакций и условия возникновения и течения химических реакций. Атомы и молекулы. Вещества молекулярного и немолекулярного строения. Качественный и количественный состав вещества. Простые и сложные вещества. Химический элемент. Язык химии. Знаки химических элементов, химические формулы. Закон постоянства состава веществ. Атомная единица массы. Относительная атомная и молекулярная массы. Количество вещества, моль. Молярная масса. Валентность химических элементов. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности. Атомно-молекулярное учение. Закон сохранения массы веществ. Химические уравнения. Классификация химических реакций по числу и составу исходных и полученных веществ. Демонстрации. Ознакомление с образцами простых и сложных веществ. Способы очистки веществ: кристаллизация, дистилляция, хроматография. Опыты, подтверждающие закон сохранения массы веществ. Химические соединения количеством вещества 1 моль. Модель молярного объема газов. Лабораторные опыты. Рассмотрение веществ с различными физическими свойствами. Разделение смеси с помощью магнита. Примеры физических и химических явлений. Реакции, иллюстрирующие основные признаки характерных реакций. Разложение основного карбоната меди(II). Реакция замещения меди железом. Практические работы
Расчетные задачи. Вычисление относительной молекулярной массы вещества по формуле. Вычисление массовой доли элемента в химическом соединении. Установление простейшей формулы вещества по массовым долям элементов. Вычисления по химическим уравнениям массы или количества вещества по известной массе или количеству одного из вступающих или получающихся в реакции веществ. Тема 2. Кислород (5 ч) Кислород. Нахождение в природе. Физические и химические свойства. Получение, применение. Круговорот кислорода в природе. Горение. Оксиды. Воздух и его состав. Медленное окисление. Тепловой эффект химических реакций. Топливо и способы его сжигания. Защита атмосферного воздуха от загрязнений. Демонстрации. Получение и собирание кислорода методом вытеснения воздуха, методом вытеснения воды. Определение состава воздуха. Коллекции нефти, каменного угля и продуктов их переработки. Лабораторные опыты. Ознакомление с образцами оксидов. Практическая работа. Получение и свойства кислорода. Расчетные задачи. Расчеты по термохимическим уравнениям. Тема 3. Водород (3 ч) Водород. Нахождение в природе. Физические и химические свойства. Водород — восстановитель. Получение, применение. Демонстрации. Получение водорода в аппарате Киппа, проверка водорода на чистоту, горение водорода, собирание водорода методом вытеснения воздуха и воды. Лабораторные опыты. Получение водорода и изучение его свойств. Взаимодействие водорода с оксидом меди(II). Тема 4. Растворы. Вода (6 ч) Вода — растворитель. Растворимость веществ в воде. Определение массовой доли растворенного вещества. Вода. Методы определения состава воды — анализ и синтез. Физические и химические свойства воды. Вода в природе и способы ее очистки. Круговорот воды в природе. Демонстрации. Анализ воды. Синтез воды. Практическая работа. Приготовление растворов солей с определенной массовой долей растворенного вещества. Расчетные задачи. Нахождение массовой доли растворенного вещества в растворе. Вычисление массы растворенного вещества и воды для приготовления раствора определенной концентрации. Тема 5. Основные классы неорганических соединений (9 ч) Оксиды. Классификация. Основные и кислотные оксиды. Номенклатура. Физические и химические свойства. Получение. Применение. Основания. Классификация. Номенклатура. Физические и химические свойства. Реакция нейтрализации. Получение. Применение. Кислоты. Классификация. Номенклатура. Физические и химические свойства. Вытеснительный ряд металлов Н. Н. Бекетова. Применение. Соли. Классификация. Номенклатура. Физические и химические свойства. Способы получения солей. Генетическая связь между основными классами неорганических соединений. Демонстрации. Знакомство с образцами оксидов, кислот, оснований и солей. Нейтрализация щелочи кислотой в присутствии индикатора. Лабораторные опыты. Опыты, подтверждающие химические свойства кислот, оснований. Практическая работа. Решение экспериментальных задач по теме «Основные классы неорганических соединений». Тема 6. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома (8 ч) Первые попытки классификации химических элементов. Понятие о группах сходных элементов. Периодический закон Д. И. Менделеева. Периодическая таблица химических элементов. Группы и периоды. Короткий и длинный варианты периодической таблицы. Значение периодического закона. Жизнь и деятельность Д. И. Менделеева. Строение атома. Состав атомных ядер. Электроны. Изотопы. Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева. Лабораторные опыты. Взаимодействие гидроксида цинка с растворами кислот и щелочей. Тема 7. Строение веществ. Химическая связь (9 ч) Электроотрицательность химических элементов. Основные виды химической связи: ковалентная неполярная, ковалентная полярная, ионная. Валентность элементов в свете электронной теории. Степень окисления. Правила определения степени окисления элементов. Окислительно-восстановительные реакции. Кристаллические решетки: ионная, атомная и молекулярная. Кристаллические и аморфные вещества. Зависимость свойств веществ от типов кристаллических решеток. Демонстрации. Ознакомление с моделями кристаллических решеток ковалентных и ионных соединений. Сопоставление физико-химических свойств соединений с ковалентными и ионными связями. Тема 8. Закон Авогадро. Молярный объем газов (3 ч) Закон Авогадро. Молярный объем газов. Относительная плотность газов. Объемные отношения газов при химических реакциях. Расчетные задачи. Объемные отношения газов при химических реакциях. Вычисления по химическим уравнениям массы, объема и количества вещества одного из продуктов реакции по массе исходного вещества, объему или количеству вещества, содержащего определенную долю примесей. Тема 9. Галогены (6 ч) Положение галогенов в периодической таблице и строение их атомов. Хлор. Физические и химические свойства хлора. Применение. Хлороводород. Соляная кислота и ее соли. Сравнительная характеристика галогенов. Демонстрации. Знакомство с образцами природных хлоридов. Знакомство с физическими свойствами галогенов. Получение хлороводорода и его растворение в воде. Лабораторные опыты. Распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода. Вытеснение галогенов друг другом из раствора их соединений. Практическая работа. Получение соляной кислоты и изучение ее свойств. 6. Учебно-тематический план
8. Итоговые комплексные работы Контрольная работа №1 по теме «Первоначальные химические понятия» Вариант I 1. В левом столбце под номерами 1—4 записаны известные вам понятия, в правом столбце буквами А—Г обозначены их характеристики. Выпишите номер, которым обозначено понятие, и букву, соответствующую его характеристике.
2. Очистить железные опилки от порошка серы можно 1) фильтрованием 2) с помощью магнита 3) нагреванием 4) растиранием смеси в ступке 3. Правильно вложен фильтр в воронку для проведения опыта по разделению смеси на рисунке  4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы кислород, сера, углерод и железо. Один из рисунков не изображает состав сложного вещества — это 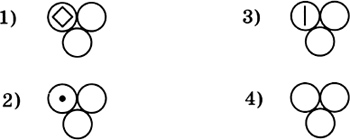 5. Только сложные вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 6. Какая запись обозначает, что молекула азота состоит из двух атомов? 1) 2N 2) N2 3) N2O 4) N2O3 7. В соединении с водородом валентность II всегда имеют химические элементы 1) S, N 2) О, S 3) О, С 4) S, Cl 8. Среди приведенных схем химических реакций к реакциям соединения относится 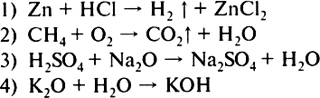 9. Массовая доля химического элемента фосфора в оксиде фосфора(V) равна 1) 19,2% 2) 36,4% 3) 43,7% 4) 100% 10. В результате окисления 3,2 г меди кислородом получен оксид меди(П) количеством вещества 1) 0,01 моль 2) 0,05 моль 3) 0,4 моль 4) 1,5 моль Вариант II 1. Покажите стрелкой вертикальной (
2. Фильтрованием можно разделить смесь 1) воды и сахара 2) воды и поваренной соли 3) воды и угольной пыли 4) воды и уксусной эссенции 3. Чтобы правильно погасить пламя спиртовки, нужно 1) подуть на пламя 2) надеть на пламя колпачок 3) накрыть пламя руками 4. На приведенных ниже рисунках показан состав веществ, в которые могут входить химические элементы железо, кислород, сера и медь. Состав простого вещества изображает рисунок  5. Только простые вещества перечислены в ряду 1) воздух, вода, кислород 2) серная кислота, водород, озон 3) кислород, азот, хлор 4) поваренная соль, вода, сероводород 6. Запись 2O2 обозначает 1) четыре атома кислорода 2) два атома кислорода 3) две молекулы кислорода 4) четыре молекулы кислорода 7. Валентность V азот имеет в каждом из веществ, указанных в ряду 1) N2O5, HNO3, HNO2 2) NH3, NO2, N2O5 3) KNO3, N2O5, HNO3 4) NH3, HNO3, NO 8. Среди приведенных схем химических реакций к реакциям разложения относится 1) Cu + Н2SO4 (конц.) 2) HgO 3) Н2 + O2 4) FеО + НСl 9. Массовая доля химического элемента натрия в сульфиде натрия равна 1) 0,28 2) 0,46 3) 0,59 4) 0,78 10. При полном сжигании алюминиевой фольги в 0,6 моль кислорода можно получить оксид алюминия количеством вещества 1) 0,4 моль 2) 1,2 моль 3) 3,5 моль 4) 4 моль Контрольная работа№2 по темам «Кислород», «Водород», «Растворы. Вода» Вариант I 1. Нарисуйте схему прибора, с помощью которого можно получить и собрать кислород в лаборатории методом вытеснения воды. 2. Перечислите области применения водорода. На каких физических или химических свойствах основано это применение? 3. Допишите уравнения химических реакций, укажите, какими из них можно воспользоваться для получения водорода. Назовите тип каждой реакции. а) СuО + Н2 б) Al + НСl в) Zn + ... 4. Допишите уравнения реакций, характеризующих химические свойства водорода:  Укажите, окисляется или восстанавливается водород в этих реакциях. 5. Для засолки огурцов приготовили 5 кг 6%-ного раствора поваренной соли. Вычислите, какие массы соли и воды потребовались для приготовления этого раствора. Вариант II 1. Нарисуйте схему прибора, с помощью которого можно получить и собрать водород в лаборатории методом вытеснения воздуха. 2. В одном столбце приведенной ниже таблицы перечислены (под номерами 1—5) важнейшие области применения кислорода. Во втором столбце таблицы буквами А—Е обозначены свойства кислорода, лежащие в основе его применения. Приведите в соответствие записи таблицы.
3. Допишите уравнения химических реакций: а) ... + O2 б) Fе + O2 в) S + ... г) CuS + ... Назовите полученные вещества. 4. Допишите уравнения химических реакций, характеризующих химические свойства водорода: Укажите, окисляется или восстанавливается водород в этих реакциях. 5. 200 г 15%-ного раствора сахара упарили наполовину. Какой стала после этого массовая доля сахара в растворе? Контрольная работа№3 по теме «Важнейшие классы неорганических соединений» Вариант I А-1. Формулы только кислот приведены в ряду 1) НСl, NaCl, HNO3 2) H2SO3, H2SO4, H2S 3) Ca(OH)2, H3PO4, Ca3(PO4)2 4) Na2O, NaNO3, HNO3 А-2. Формулы только щелочей приведены в ряду 1) Fe(OH)2, KOH, Ва(ОН)2 2) NaOH, Ca(OH)2, Cu(OH)2 3) KOH, NaOH, LiOH 4) Fe(OH)3, Cu(OH)2, NaOH A-3. Оксид, который реагирует с гидроксидом натрия, образуя соль,— это 1) Fe2O3 2) К2О 3) SO3 4) BaO A-4. Взаимодействие оксида с водой относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения А-5. Взаимодействие гидроксида меди(II) с азотной кислотой относится к реакциям 1) соединения 2) разложения 3) замещения 4) обмена А-6. Индикатор фенолфталеин в щелочной среде становится 1) бесцветным 2) малиновым 3) красным 4) желтым А-7. Свойство, которое является общим для нерастворимых оснований и щелочей,— это 1) взаимодействие с кислотными оксидами 2) взаимодействие с кислотами 3) взаимодействие с солями 4) разложение В-8. Даны формулы веществ: FeO, K2O, CO2, MgO, CrO, CrO3, SO2, Р2О5 Выпишите формулы только основных оксидов. Ответ:_______________________________ В-9. Установите соответствие между химической формулой вещества и классом неорганических соединений, к которому оно принадлежит.
В-10. Установите соответствие между исходными веществами и продуктами химических реакций.
В-11. Вставьте в схемы химических реакций недостающие формулы веществ. 1) ... + ... 2) ... + ... 3) ... + ... 4) ... + ... В-12. Допишите уравнения химических реакций. 1) LiОН + SO3 2) NaOH + Р2О5 3) Са(ОН)2 + СО2 4) Ва(ОН)2 + SO2 С-13. Даны вещества: соляная кислота, гидроксид кальция, вода, оксид фосфора(V), оксид магния. С какими из перечисленных веществ может взаимодействовать: а) гидроксид натрия; б) гидроксид железа(III)? Напишите уравнения соответствующих реакций. Укажите тип каждой реакции. С-14. Как отмыть пробирку от остатков нерастворимого в воде основания? С-15. Составьте уравнения химических реакций, соответствующих схеме 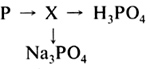 Вариант II А-1. Формулы только солей приведены в ряду 1) K2СО3, Н2СО3, KOH 2) АlСl3, Al(NO3)3, Al2S3 3) H2S, Ba(NO3)2, BaCl2 4) Cu(OH)2, CuSO4, CuS A-2. Формулы только бескислородных кислот приведены в ряду 1) НСl, HNO3, H2S 2) H2SO3, H2S, HNO2 3) Н3РО4, Н2СО3, H2S 4) H2S, HF, HCl A-3. Оксид, который реагирует с кислотой, образуя соль, — это 1) Р2О5 2) СuО 3) SO2 4) СО2 А-4. Получение оксида металла при нагревании гидроксида металла относится к реакциям 1) соединения 2) обмена 3) разложения 4) замещения А-5. Химическая реакция, уравнение которой K2О + 2HNO3 = 2KNO3 + Н2О, относится к реакциям 1) разложения 2) соединения 3) обмена 4) замещения А-6. Индикатор лакмус в щелочной среде становится 1) фиолетовым 2) красным 3) синим 4) бесцветным А-7. В каком ряду все основания, формулы которых приведены, разлагаются при нагревании? 1) NaOH, Сr(ОН)2, Са(ОН)2 2) Fe(OH)3, Cu(OH)2, Fe(OH)2 3) Ва(ОН)2, Mg(OH)2, KOH 4) KOH, LiOH, Al(OH)3 В-8. Даны формулы веществ: СО2, Na2O, СаО, МnО, Мn2О7, Сl2О7, Li2O, P2O5 Выпишите формулы только кислотных оксидов. Ответ: _____________________________________ В-9. Установите соответствие между химической формулой вещества и его названием.
В-10. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
В-11. Вставьте в схемы уравнений химических реакций недостающие формулы веществ. 1) ... + KOH 2) ... + НСl 3) HNO3 + KOH 4) ... + ... В-12. Допишите уравнения химических реакций, протекающих при нагревании. 1) Mg(OH)2 2) Аl(ОН)3 3) Fe(OH)3 4) Cu(OH)2 С-13. С какими из перечисленных веществ: вода, оксид углерода(IV), азотная кислота, гидроксид кальция, поваренная соль — может вступать в реакцию: а) оксид кальция: б) оксид фосфора(V); в) оксид кремния(IV)? Запишите уравнения возможных химических реакций. С-14. В трех склянках без этикеток находятся оксиды: в одной — оксид кальция, в другой — оксид меди(II), в третьей — оксид фосфора(V). Как их можно распознать? С-15. Составьте уравнения химических реакций, соответствующих схеме  Контрольная работа№4 по темам «Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома» и «Строение вещества. Химическая связь» Вариант I 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 5; б) 2, 8, 6; в) 2, 8, 8; г) 2, 8, 5. Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют. 2. Расположите: а) в порядке ослабления металлических свойств химические элементы Na, Li, Cu, Rb, K; б) в порядке усиления неметаллических свойств химические элементы Si, Al, Cl, P, S. 3. Определите по формулам степени окисления атомов в бинарных соединениях. Назовите вещества. Подчеркните наиболее электроотрицательный химический элемент. АlСl3, HF, NH3, CaBr2, NO2, IF7. 4. Запишите формулу сероводорода. Определите вид химической связи. Составьте схему ее образования. 5. Поясните, какую кристаллическую решетку имеет карбид кремния (SiC), если известно, что это вещество используют как абразивный материал. 6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным? а) 2Na + 2Н2О = 2NaOH + Н2 б) K2О + Н2О = 2KOH в) СаО + 2НСl = СаСl2 + Н2О г) Fe + H2SO4 = FeSO4 + H2 Вариант II 1. Назовите химический элемент, определите заряд ядра атомов этого элемента, зная распределение электронов в его атомах: а) 2, 8, 2; б) 2, 8, 7; в) 2, 8, 8; г) 2, 8, 8, 2. Какие из этих химических элементов имеют сходные свойства? Составьте формулы их оксидов, гидроксидов, летучих водородных соединений, если они их образуют. 2. Расположите: а) в порядке усиления металлических свойств химические элементы Ва, Sr, Mg, Ca, Be; б) в порядке ослабления неметаллических свойств химические элементы F, В, N, О, С. 3. Составьте формулы веществ. Проставьте степени окисления над знаками химических элементов в каждой формуле. Подчеркните наиболее электроотрицательный химический элемент. а) нитрид кальция б) оксид марганца(VII) в) карбид кремния 4. Какая из схем соответствует изображению химической связи, удерживающей атомы в оксиде лития Назовите вид этой химической связи. 5. Поясните, какую кристаллическую решетку имеет иод, если известно, что это вещество легко возгоняется. 6. Какие химические реакции, уравнения которых приведены ниже, относятся к окислительно-восстановительным? а) Na2O + Н2О = 2NaOH б) СаСО3 = СаО + СО2 в) Zn + 2HCl = ZnCl2 + H2 г) 2Mg + О2 = 2MgO Контрольная работа№5 по темам «Закон Авогадро. Молярный объем газов» и «Галогены» Вариант I 1. Жидким галогеном является 1) хлор 2) фтор 3) бром 4) иод 2. Составьте схему строения атома хлора. Укажите общее число и число неспаренных электронов. Запишите формулы типичных соединений. 3. Наиболее сильный окислитель — это 1) хлор 2) бром 3) фтор 4) иод 4. Составьте уравнение реакции, расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель. KВr + Сl2 5. Степень окисления хлора в хлорной кислоте 1) +5 2) +1 3) –1 4) +7 5) 0 6. Составьте два уравнения реакций: а) соединения; б) замещения, в которых участвуют галогены. 7. Наиболее прочная галогеноводородная кислота — это 1) НСl 2) НВr 3) HI 4) HF 8. Составьте уравнения реакций, позволяющих характеризовать химические свойства соляной кислоты или других галогеноводородных кислот. 9. Вычислите объемы хлора и водорода (н. у.), необходимых для получения 20 м3 хлороводорода. Вариант II 1. Галоген, представляющий собой твердое вещество, — это 1) фтор 2) хлор 3) бром 4) иод 2. Составьте схему строения атома фтора. Укажите общее число электронов, вращающихся вокруг ядра атома, и число электронов, находящихся на наружном электронном слое. 3. Галоген, который способен возгоняться, — это 1) фтор 2) хлор 3) бром 4) иод 4. Расставьте коэффициенты в схеме реакции с помощью электронного баланса. Укажите, какое вещество окисляется, какое восстанавливается. MnO2 + HCl 5. Степень окисления хлора в бертолетовой соли KСlO3 1) –1 2) +1 3) +5 4) +7 5) 0 6. Составьте два уравнения реакций, в которых один галоген вытесняет другой из соли. 7. Различить галогеноводородные кислоты и их соли можно с помощью одного реактива 1) хлорной воды 2) AgNO3 3) крахмального клейстера 4) Cu 8. С какими из перечисленных веществ будет реагировать соляная кислота: ртуть, оксид меди(II), алюминий, гидроксид калия, карбонат калия? Напишите уравнения возможных реакций. 9. Для реакции взяли 5 л хлора и 2 л водорода (н. у.). Смесь взорвали. Каков объем полученного хлороводорода? Какой газ остался в избытке? 9. Описание обеспечения образовательного процесса Дополнительная литература для учителя
Дополнительная литература для учащихся
9 класс 1. Пояснительная записка Рабочая программа по химии составлена на основе федерального компонента государственного стандарта основного общего образования, примерной программы основного общего образования и программы курса химии для 8-9 классов общеобразовательных учреждений автора Н.Н. Гара, полностью отражающей содержание Примерной программы, с дополнениями, не превышающими требования к уровню подготовки обучающихся. Программа состоит из пяти разделов:
|