Тема: факторы, влияющие на скорость химической реакции
 Скачать 65.98 Kb. Скачать 65.98 Kb.
|
| ТЕМА: ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ. ЦЕЛЬ: Изучить факторы, влияющие на скорость химической реакции. ЗАДАЧИ: 1.Закрепить знания учащихся о гомогенных и гетерогенных реакциях, о скорости химической реакции. 2. Экспериментально изучить влияние некоторых факторов на скорость химической реакции. 3. Дать понятие о катализаторах и ингибиторах. 4. Продолжить формирование умений учащихся наблюдать, анализировать, сравнивать, обобщать, работать с лабораторным оборудованием. 5. Работать над накоплением словаря по теме. 6. Контролировать правильность произношения. 7. Развивать слуховое восприятие у слабослышащих учеников. 8. Развивать у школьников логическое мышление, творчество и интерес к предмету. СЛОВАРЬ: степень окисления, скорость химической реакции, концентрация веществ, интенсивнее, поверхность соприкосновения веществ. ОБОРУДОВАНИЕ: Периодическая система химических элементов, опорные таблицы, колбы, пробирки, штатив, спиртовка, растворы серной, соляной и уксусной кислот, цинк, сера, оксид меди (II), кусочки мрамора, мела, 5% раствор пероксида водорода, оксид марганца(IV), лучинка. ХОД УРОКА. 1.Организационный момент. Проверка слуховых аппаратов. 2.Речевая работа. Контроль звуков Ц-С. а) Прочитать и произнести правильно: - степень окисления, - скорость химической реакции, - концентрация веществ, - интенсивнее, - поверхность соприкосновения веществ. б) Назвать химические элементы, в названии которых есть звуки Ц, С. Кальций, сера, свинец, стронций, кислород, осмий и т.д. 3.Закрепление раннее изученного материала. Фронтальный опрос. Вступительное слово учителя. Мы продолжаем изучать основные закономерности протекания химических реакций. Настало время поговорить о продолжительности химической реакции, т.е. о протекании химического процесса во времени, за которое он происходит. И задачами сегодняшнего урока является выявление факторов, которые влияют на скорость химической реакции. Запишите тему, число.
Скажите, а вы встречались в своей жизни с реакциями идущими очень быстро? а) горение; б) сода + уксус; Эти реакции высокой скорости.
а) ржавление железа; б) скисание молока. Для полного гниения брошенной в лесу газеты нужен 1 год. Ржавление консервной банки происходит в течение 10 лет. Стекло практически не разрушается в течение столетий. Эти реакции низкой скорости. Чтобы характеризовать быстроту химической реакции, пользуются понятием скорость химической реакции.
Скорость химической реакции – это изменение концентрации вступившего в реакцию или образовавшегося вещества в единицу времени.
V = C2 – C1 / t2 – t1 = ΔC/Δt
Реакции бывают гомогенные и гетерогенные.
Гомогенные реакции – это реакции, в которых вещества образуют однородную систему. К этим реакциям относятся реакции между газами, между жидкими веществами.
Гетерогенные реакции – это реакции, в которых реагенты находятся в разных фазах. Они протекают между твердыми веществами и газами, твердыми веществами и жидкостями. 4. Работа над темой урока. Факторы, влияющие на скорость химической реакции. а) ПРИРОДА РЕАГИРУЮЩИХ ВЕЩЕСТВ. Демонстрация взаимодействия цинка с соляной и уксусной кислотами. - Какая реакция идет быстрее? (Реакция с соляной кислотой.) - Какой газ выделяется в пробирке 1?( Выделяется водород.) - Напишите уравнение реакции. Zn + 2 HCl = ZnCl2 + H2↑ - Вывод: скорость реакции зависит от природы реагирующих веществ. б) КОНЦЕНТРАЦИЯ РЕАГИРУЮЩИХ ВЕЩЕСТВ. - Рассмотрим горение серы на воздухе и в кислороде. Учитель демонстрирует опыт горения серы на воздухе и в колбе с кислородом. - Где реакция идет интенсивнее? ( Интенсивнее сера горит в кислороде.) - Напишите уравнение реакции горения серы. S + O2 = SO2 - Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная реакция) - Вывод: скорость реакции зависит от концентрации реагирующих веществ. в) ТЕМПЕРАТУРА РЕАКЦИИ. - Рассмотрим взаимодействие оксида меди (II) и серной кислоты. Что наблюдаем? - Нагреем пробирку. - Что вы отметили? (Голубой цвет раствора.) - Напишите уравнение этой реакции. CuO + H2SO4 = CuSO4 + H2O - Почему изменилась окраска раствора? (Черный осадок оксида меди растворился в кислоте, образуя сульфат меди голубого цвета.) - На скорость реакции влияет еще и площадь поверхности соприкосновения тел. Опыт, доказывающий это, вы проведете сами. Повторение правила техники безопасности при работе в химическом кабинете. Работа по опорным таблицам. Следующую реакцию ученики проводят самостоятельно. г) ПЛОЩАДЬ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ ВЕЩЕСТВ. - Проведите реакцию взаимодействия карбоната кальция с соляной кислотой. - Налейте в две пробирки соляной кислоты и опустите в одну кусочек мрамора, а в другую мраморную крошку. - Как протекают реакции в пробирках? В чем разница? ( В пробирке с мраморной крошкой реакция идет интенсивнее.) - Почему реакции идут с разной интенсивностью? (Площадь поверхности измельченного вещества больше.) - Напишите уравнение реакции. CaCO3 + 2 HCl = CaCl2 + CO2↑ + H2O - Какай газ выделяется? ( Выделяется углекислый газ.) - В какой пробирке реакция закончилась быстрее? (В пробирке с мраморной крошкой.) - Какая это реакция: гомогенная или гетерогенная? (Это гетерогенная реакция) д) ПРИСУТСТВИЕ КАТАЛИЗАТОРА. Демонстрация опыта разложения пероксида водорода в присутствии оксида марганца. - Нальем пероксид водорода в стаканчик и внесем тлеющую лучинку, она не загорается, т.к. при обычных условиях реакция разложения протекает очень медленно. Если же внести в стаканчик немного оксида марганца (IV), то начинается бурное выделение газа, внесенная тлеющая лучинка загорается ярким пламенем. - Напишите уравнение реакции. H2O2 = 2H2O + O2́́́́↑ - МпО2 – катализатор, он не расходуется в реакции. - Откройте учебники на странице 90, прочитайте текст и найдите ответы на вопросы: 1. Дать определение катализатора. 2. Какие реакции называют каталитическими? 3. Что такое ингибиторы? 5. Использование знаний о скорости реакции в быту.
(Чтобы замедлить химические реакции, ведущие к порче продуктов)
В каком случае приготовление пищи происходит быстрее? (При тепловой обработке продуктов происходят химические реакции. Пища готовиться быстрее при большем нагревании)
Какое другое название можно дать этим веществам? (Это ингибиторы. Они замедляют скорость химических реакций) 6. Заключение. Подведение итогов урока. - Какая была тема нашего урока? - Перечислите факторы, влияющие на скорость химической реакции? - Как мы можем использовать свои знания о скорости химической реакции в быту? - Есть ли у нас вопросы? Все ли понятно? Оценка работы учеников. 7. Домашнее задание. §16.3 прочитать, выучить уравнения реакций и определения. 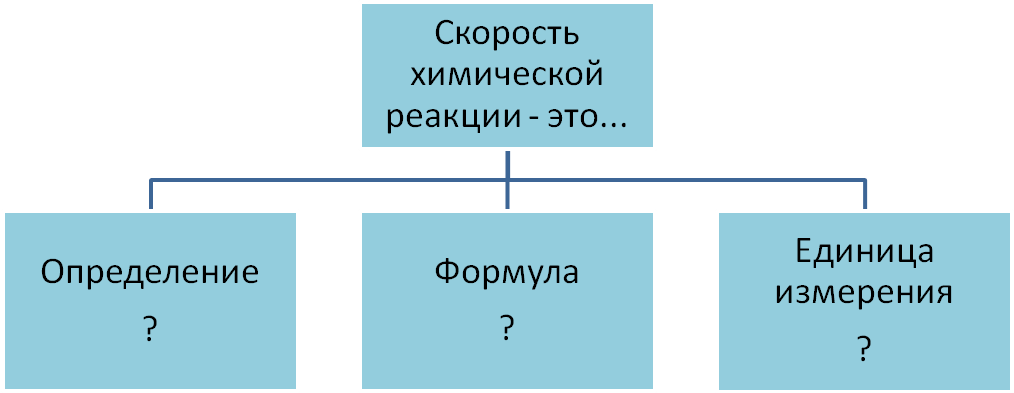 Открытый урок на тему: «Факторы, влияющие на скорость химической реакции. Катализаторы» Из опыта работы учителя химии Куксовой М. А. ГСОУ школа-интернат I, II вида г. Тихорецка |