|
Задания школьного этапа Всероссийской олимпиады школьников по химии 11 класс (2013-2014 уч г.) Задание 1
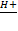 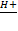 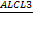 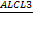 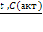 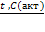 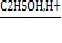 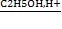 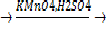 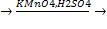 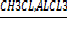 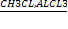 Задания школьного этапа Всероссийской олимпиады школьников по химии 11 класс (2013-2014 уч.г.) Задания школьного этапа Всероссийской олимпиады школьников по химии 11 класс (2013-2014 уч.г.)
Задание 1.
Приведите примеры реакций между двумя кислотами при условии, что: а) обе кислоты – неорганические; б) одна кислота органическая, другая – неорганическая. Решите аналогичную задачу для двух оснований. Для каждого случая напишите не более двух уравнений реакций.
(4 балла)
Задание 2.
Для трех химических элементов X, Y, Z известно, что они принимают участие в следующих превращениях:
Z2 + 3X2 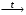 2ZX3 2ZX3
2X2 + Y2 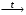 2X2Y 2X2Y
4X3Z + 3Y2 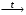 2Z2 + 6X2Y 2Z2 + 6X2Y
4XZY3 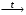 4ZY2 + Y2 + 2X2Y 4ZY2 + Y2 + 2X2Y
Z2 + Y2 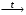 2YZ 2YZ
2ZY + Y2 = 2ZY2
3ZY2 + X2Y = 2XZY3 + YZ
О каких химических элементах идет речь в задании?
(7 баллов)
Задание 3.
Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
(3 балла)
Задание 4.
Пероксид натрия обработали избытком горячей воды. Выделившийся газ собрали, а образовавшийся раствор щелочи полностью нейтрализовали 10%-ным раствором серной кислоты объемом 300мл и плотностью 1,08 г/мл. Определите массу взятого для реакции пероксида натрия и объем собранного газа.
(4 балла)
Задание 5.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H2→C6H6→ →X1→X2→→X3→бензоат калия
(5 баллов)
Задание 6.
В пробирках имеются концентрированные растворы следующих кислот: щавелевой, серной, иодоводородной, фосфористой, азотной, муравьиной.
1. Как, не привлекая никаких других реактивов, установить содержимое каждой пробирки?
2. Напишите уравнения реакций.
3. Укажите признаки реакций.
(20 баллов)
Ответы к заданиям олимпиады по химии 11 класс и их оценивание
Максимальное количество баллов – 43
Призёры - учащиеся, набравшие более 22 баллов
Победитель – учащийся, набравший максимальный балл среди призёров
Задание 1.
Наиболее простые реакции между двумя кислотами – окислительно-восстановительные, а между двумя основаниями – комплексообразования. Например:
а) H2S + H2SO4 = S + SO2 + 2H2O
HOOC–COOH + H2SO4 = CO2 + SO2 + H2O
б) 2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
Cu(OH)2 + 4NMe3 = [Cu(NMe3)4](OH)2
За каждое верное уравнение по 1 баллу, максимальное количество баллов – 4.
Задание 2.
N2 + 3H2 = 2NH3
2H2 + O2 = 2H2O
4NH3 + 3O2 = 2N2 + 6H2O
t
4HNO3 = 4NO2 + O2 +2H2O
t
N2 + O2 =2NO
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
Элементы Х – водород (Н), Z – азот (N), Y – кислород (О).
За каждое верное уравнение по 1 баллу, максимальное количество баллов – 7.
Задание 3.
Задание 4.
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла.)
|
Баллы
|
Элементы ответа
Уравнения реакций:
1)2Na2O2 + 2H2O = 4NaOH + O2↑
2NaOH + H2SO4 = Na2SO4 + 2H2O
2)Рассчитаны количества вещества серной кислоты и щелочи:
n(H2SO4) = (300•1,08•0,1)/98 = 0,33(моль)
n(NaOH) = 2n(H2SO4) = 2n(H2SO4) = 2•0,33 = 0,66(моль)
3)Рассчитаны количества вещества и масса пероксида натрия:
n(Na2O2) = 0,5n(NaOH) = 0,5•0,66 = 0,33 (моль)
m(Na2O2) = 0,33•78 = 25,74 (г)
4)Рассчитано количество вещества и объем кислорода:
n(O2) = 0,25n(NaOН) = 0,25•0,66 = 0,165 (моль)
V(O2) = n•Vm = 0,165•22,4 = 3,696л ≈3,7 л.
|
|
Ответ правильный и полный, включает все названные выше элементы
|
4
|
В ответе допущены ошибки только во2-ом, или в 3-ем, или в 4-ом элементе
|
3
|
В ответе допущены ошибки в двух элементах
|
2
|
В ответе допущена ошибка в первом элементе, которая повлекла ошибки в последующих элементах
|
1
|
Все элементы записаны неверно
|
0
|
Максимальный балл
|
4
|
Задание 5.
Содержание верного ответа (допускаются иные формулировки ответа, не искажающие его смысла.)
|
Балл
|
1)3C6H6→→С6Н6
|
|
2)С6Н6 + СН3CL→→C6H5CH3 + HCL
|
|
3) 5C6H5CH3 +6 KMnO4 + 9H2SO4 →5C6H5COOH + 6MnSO4 + 3 K2SO4 + 14 H2O
|
|
4)C6H5COOH + C2H5OH →→C6H5COOC2H5 +H2O
|
|
5)C6H5COOC2H5 + KOH → C6H5COOK + C2H5OH
|
|
Ответ правильный и полный, включает все названные выше элементы
|
5
|
Правильно записаны 4 уравнения реакций
|
4
|
Правильно записаны 3 уравнения реакций
|
3
|
Правильно записаны 2 уравнения реакций
|
2
|
Правильно записано 1 уравнение реакции
|
1
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
5
|
Задание 6.
Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
Концентрированная серная кислота как сильный окислитель будет взаимодействовать с иодоводородной кислотой, проявляющей восстановительные свойства:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Выпадает коричневый осадок йода и выделяется сероводород с неприятным запахом тухлых яиц.
|
1
2
2
|
Специфическим свойством муравьиной кислоты является ее способность разлагаться на оксид углерода (II) и воду под действием концентрированной серной кислоты, проявляющей водоотнимающие свойства:
H2SO4(к)
НСООН → CO + H2O
выделяется бесцветный газ без запаха
|
1
2
2
|
Концентрированная серная кислота при нагревании отнимает от щавелевой кислоты воду:
t0, H2SO4(к)
Н2С2О4 → СО2 + CO + H2O
выделяются бесцветные газы
|
1
2
1
|
Фосфористая кислота как восстановитель может реагировать с азотной кислотой, являющейся сильным окислителем:
H3PO3 + 2HNO3 = H3PO4 + 2NO2 + H2O
выделяется бурый газ
|
1
2
1
|
Азотная и серная кислоты, являющиеся сильными окислителями друг с другом не реагируют
|
2
|
Все элементы ответа записаны неверно
|
0
|
Максимальный балл
|
20
| |
|
|
 Скачать 88.21 Kb.
Скачать 88.21 Kb.
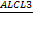
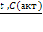
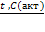
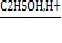
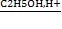
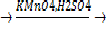
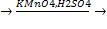
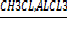
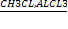 Задания школьного этапа Всероссийской олимпиады школьников по химии 11 класс (2013-2014 уч.г.)
Задания школьного этапа Всероссийской олимпиады школьников по химии 11 класс (2013-2014 уч.г.) 2ZX3
2ZX3  2X2Y
2X2Y  2Z2 + 6X2Y
2Z2 + 6X2Y 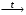 4ZY2 + Y2 + 2X2Y
4ZY2 + Y2 + 2X2Y 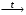 2YZ
2YZ