Методические рекомендации для выполнения лабораторных работ. Контрольные вопросы
 Скачать 175.44 Kb. Скачать 175.44 Kb.
|
| Методические рекомендации для выполнения лабораторных работ. Контрольные вопросы. Ответы на контрольные вопросы по темам Вы можете найти в лекциях по предмету или в рекомендуемой литературе. Данные вопросы являются базовыми в освоении предмета “Органическая химия”, поэтому, зная ответы на них Вы сможете без особых затруднений выполнить лабораторную работу, сдать зачет и экзамен по предмету. Рекомендую при подготовке ответов на контрольные вопросы вести краткий, но содержательный конспект в лекционной тетради. Эта работа обязательно пригодится Вам, так как - лекционная тетрадь неоднократно будет браться на проверку (на оценку); - Вы заранее будете готовиться к зачету и экзамену по предмету; - преподаватель имеет право спросить у студента по ходу лабораторной работы любой контрольный вопрос из предложенных. Проверка знаний. Проверка знаний к лабораторной работе будет проходить в виде тестового контроля перед началом лабораторной работы. Поэтому Вы можете заранее подготовить ответы на вопросы теста в тетради для лекций по предмету, но пользоваться этой тетрадью при проверке знаний будет нельзя (тетради берутся на проверку). Ответы на вопросы теста при подготовке дома к лабораторной работе Вы сможете взять из курса лекций или воспользоваться рекомендуемой литературой. При проверке знаний, выполняя тест, недостаточно указывать код выбранного Вами варианта ответа. На все пять вопросов необходимо отвечать на сколько можно полнее. Например, называя формулу, нужно не только выбрать правильное ее название, но и, переписав формулу, дописать ее, пронумеровать углеродные атомы согласно правилам номенклатуры, выделить заместители, - и только после этого записать название этой формулы. Если в вопросе дана схема превращений, то важно не только указать название продукта реакций, но и записать все необходимые уравнения реакций. Если же вопрос предложен в виде расчетной задачи, то при ответе сначала эту задачу необходимо решить, а затем сравнить полученный результат с предложенными в тесте вариантами ответов, и, если результат рассчитанной задачи совпал с одним из вариантов - можете смело записывать соответствующий код. Сданный тест оценивается по пятибальной системе. И если Вы заранее подготовитесь к проверке знаний, то обязательно получите соответствующую своей подготовке оценку! В случае оценки “два”, студенту придется сдавать весь теоретический материал по данной теме преподавателю во внеаудиторное время или на дополнительных занятиях (1 час в неделю для всех студентов 2-го курса). Отчеты к лабораторным работам. Чтобы самостоятельно записать необходимые реактивы и оборудование в начале каждой лабораторной работы, Вам необходимо ознакомиться с содержанием опытов по соответствующей работе. Выполнять опыты можно только после ознакомления с правилами техники безопасности при работе в лаборатории (см. выше). После проделывания опыта Вы самостоятельно делаете рисунок или схему этого опыта (аккуратно!), записываете соответствующие наблюдения и уравнения реакций, а так же вывод по опыту. После этого необходимо записать общий вывод по лабораторной работе, где особое внимание нужно уделить объяснению изученных в ходе опытов свойств органических соединений и сравнению их с другими ранее изученными с точки зрения теории строения органических соединений А. М. Бутлерова. Рекомендации к лабораторной работе № 1. Опыт №1: В разделе “наблюдения и уравнения реакций” определите молекулярную массу взятых спиртов для опыта и сделайте вывод о зависимости растворимости спиртов от их молекулярной массы. Для доказательства амфотерности спиртов приведите соответствующие уравнения реакций (см. лекцию по теме “Спирты”). Опыт №2: Запишите уравнения реакций горения взятых для опыта спиртов по схеме (расставте коэффициенты): ROH + O2 —› CO2 + H2O Для объяснения характера горения спиртов (пламя - голубое, ярко-желтое, слегка коптящее или сильно коптящее) рассчитайте %-ное содержание атомов углерода в молекулах спиртов по формуле : n • Ar(C) w(C) = ———— • 100% , где n - число атомов С. M(ROH) Опыт №3: Реактив Лукаса готовят следующим образом : в 100 мл конц. HCI растворяют 155 г ZnCI2 (хранят в склянке с притертой пробкой). Напишите уравнения реакций взятых для опыта спиртов с HCI, указав какой спирт быстрее реагирует с реактивом Лукаса. Укажите механизм этих реакций (см. лекцию по теме). Сделайте вывод об основных свойствах спиртов. Опыт №4: Запишите уравнение реакции взаимодействия спиртов с Na(расставте коэффициенты) по схеме: ROH + Na —› RONa + H2 , так как образовавшиеся алкоголяты нестойкие, то они сразу же гидролизуются (при этом окраска ф-ф изменяется в малиновую) с образованием соответствующего спирта и щелочи. Сделайте вывод о кислотных свойствах спиртов. Опыт №5: а) уравнение реакции окисления спиртов прокаленной медной проволокой запишите по схеме: спирт + CuO —› альдегид + Cu + H2O. б) уравнение реакции окисления спиртов хромовой смесью запишите по схеме : спирт + K2Cr2O7 + H2SO4 —› альдегид + K2SO4 + Cr2(SO4)3 + H2O , расставьте коэффициенты. Опыт №6: получение диэтилового эфира запишите по схеме t C2H5OH этанол + HO-SO3H —› C2H5 - O - SO3H ———› диэтиловый эфир н2о HO-SO3H Запишите уравнение реакции горения диэтилового эфира. Опыт №7: получение грушевой эссенции О // уксусная кислота + НОСН2СН2СН(СН3)2 ——› СН3- С - ОСН2СН2СН(СН3)2 изоамиловый спирт изоамилацетат Опыт №8: реакции образования комплексных соединений многоатомных спиртов см. в учебнике Артеменко А.И. на стр. 138 и 140. Алгоритм решения задачи в самостоятельной работе по вариантам : 1) уравнение реакции по схеме фенол + NaOH = фенолят натрия + Н2О 2) найти массу р-ра NaOH по формуле: m p = —— V 3) найти массу чистого вещества NaOH по формуле: m(ч.в.) w = ——— • 100 % m(в.в.) 4) найти - что в недостатке? 5) найти массу фенолята натрия. Рекомендации к лабораторной работе № 2. Опыт №1: уравнения реакций получения альдегидов записать по схемам а) метанол + CuO = метаналь + Cu + Н2О б) см. опыт № 5 б в Л.Р. № 1. в) глицерин + K2Cr2O7 + H2SO4 = CH2 - CH - COH + K2SO4 + Cr2(SO4)3 + H2O | | OH OH t глицериновый альдегид Коэффициенты ! г) 2KHSO4 ——› K2S2O7 + H2O K2S2O7 глицерин ————› СH2= CH- COH + 2 H2O -2KHSO4 акролеин Особенности уравнений реакций взаимодействия акролеина с Br2,КMnO4, Cu(OH): 1) акролеин + KMnO4 +H2O = глицерин + MnO2 + KOH 2) акролеин + Br2 = ... (реакция по двойной связи) 3) акролеин + Cu(OH)2 = ... (реакция на альдегидную группу) Опыт №2: окисление оксосоединений а) записать 3 уравнения реакций с предложенными альдегидами по схеме R - COH + [Ag(NH3)2]OH = R - COOH + Ag + NH3 + H2O Коэффициенты! б) записать 3 уравнения реакций с теми же альдегидами по схеме R - COH + Cu(OH)2 = R - COOH + CuOH + H2O t желтый СuOH —› Cu2O + H2O красный Коэффициенты! Особенности взаимодействия кетонов с Cu(OH)2: кетоны не вступают в реакцию окисления, поэтому слабое основание Сu(OH)2 самопроизвольно разлагается t Cu(OH)2 —› CuO + H2O черный Опыт № 3: реакция присоединения NaHSO3 к ацетону протекает по механизму АN: OH O | || ацетон + NaHSO3 —› CH3 - C -—S - O - Na | || CH3 O гидросульфитное производное Эту реакцию используют для очистки карбонильных соединений и для отделения их из трудно разделяемых смесей, так как гидросульфитное производное легко разлагается при действии на него HCI с образованием уже очищенного оксосоединения. Опыт №4: реакцию образования фенол-формальдегидной смолы см. в учебнике Потапова В.М. на стр. 186. Алгоритм решения задачи в самостоятельной работе по вариантам : 1) записать 2 уравнения реакций по схемам CaC2 + H2O = ... + ... и С2Н2 + Н2О = ... 2) найти массовую долю чистого вещества СаС2 по формуле w(CaC2) = 100 % - w(примесей) 3) найти массу чистого вещества СаС2 по формуле m(ч.в.) w = ——— • 100 % m(в.в.) 4) найти объем С2Н2 по пропорции ; 5) найти массу теоретическую альдегида по пропорции; 6) найти массу практическую по формуле mпракт. ? = ——— • 100 % mтеор. Рекомендации к лабораторной работе № 3 : Опыт №1: для объяснения различий в степени растворимости карбоновых кислот в воде необходимо сделать расчет молекулярных масс взятых кислот для опыта. Опыт №2: запишите уравнения диссоциации взятых карбоновых кислот для опыта по схеме R - COOH —› R - COO- + H+ Cделайте вывод о зависимости силы карбоновых кислот от их молекулярной массы и от их основности (количества карбоксильных групп). Опыт №3: гидролиз хлороформа в щелочной среде протекает по схеме 3NaOH NaOH H-CCI3 ———› [ H- C(OH)3] ——› H-COOH ———› H- COONa -3NaCI -H2O -H2O Обнаружение муравьиной кислоты производится по схеме t H- COONa + [Ag(NH3)2]OH —› HO - COONa + Ag + NH3 + H2O или H - COOH + ... —› СО2 + Н2О + Ag + ... Коэффициенты ! Разложение муравьиной кислоты идет по схеме t, Н+ Н - СООН ——› СО + Н2О Угарный газ горит голубыми вспышками ! Опыт №4: а) лабораторный способ получения уксусной кислоты записывается по схеме t R - COONa + конц.H2SO4 —› R - COOH + ... б) реакция с содой является качественной, при этом выделяется углекислый газ уксусная кислота + Na2CO3 —› ацетат Na + CO2 + H2O в) магний вытесняет водород из уксусной кислоты (Н2 сгорает с характерным хлопком), образуется ацетат Mg. Опыт №5: а) ВЖК при взаимодействии с щелочами образуют соли - мыла С17Н35СООН + NaOH = стеарат Na + ... б) мыла гидролизуются с образованием ВЖК и щелочи; щелочной характер Среды доказывается индикатором - ф-ф. Опыт №6: олеиновая кислота является непредельной, поэтому с раствором KMnO4 вступает в реакцию присоединения с образованием 9,10-диоксистеариновой кислоты по схеме СН3-(СН2)7-СН=СН-(СН2)7-СООН + KMnO4 + H2O = ... + MnO2 + KOH При этом р-р KMnO4 обесцвечивается. Опыт №7: а) щавелевая кислота проявляет общие свойства кислот, реагируя с щелочами СООН | + КОН = калиевые соли щавелевой к-ты + Н2О СООН б) разложение щавелевой кислоты при ее нагревании идет по схеме СООН t СООН | • 2Н2О ——› | —› СО2 + НСООН СООН -Н2О СООН Углекислый газ вызывает помутнение известковой воды СО2 + Са(ОН)2 = ... + ... Алгоритм решения задачи в самостоятельной работе по вариантам : 1) записать уравнение реакции получения грушевой эссенции (см. опыт №7 в Л.Р.№1); 2) найти массу раствора уксусной кислоты, зная его плотность и объем; 3) найти массу чистой уксусной кислоты, зная w-% раствора и его массу; 4) найти массу эссенции по пропорции. Рекомендации к лабораторной работе № 4 . Опыт №1: в выводе отметить нерастворимость жиров и масел в воде и определить по наблюдениям наилучшие органические растворители их. Опыт №2: необходимо выявить, какой из исследуемых жиров содержит наибольшее количество непредельных ВЖК (чем лучше идет обесцвечивание Br2, тем больше ВЖК содержит жир), записав 3 уравнения реакций бромирования с предложенными для опыта жирами по схеме CH2-O-CO-R СН2-О-СО-R | | CH-O -CO- R + Br2 —› CH-O-CO-R | | CH2-O-CO-(CH2)7-CH=CH-(CH2)7-CH3 CH2-O-CO-(CH2)7-CHBr-CHBr-(CH2)7-CН3 Опыт №3: Кислотным числом называют число мл КОН, необходимое для нейтрализации свободных кислот в 1 г жира. Кислотное число подсолнечного масла , пригодного для употребления в пищевой промышленности, не должно превышать 4. Кислотность жиросодержащих продуктов и сырья при длительном или неправильном их хранении повышается, так как жиры подвергаются гидролизу: t ЖИР + Н2О —› ГЛИЦЕРИН + ВЖК ! Кислотное число характеризует качество масла или жыра. В процессе титрования масла щелочью происходит нейтрализация свободных ВЖК по схеме : ВЖК + КОН —› СОЛЬ + Н2О Опыт №4: Реакция Вагнера является качественной на непредельные соединения. При взаимодействии растительного масла с водным раствором перманганата калия идет реакция присоединения -ОН групп по месту разрыва двойных связей по схеме : СН2-О-СО-R CH2-O-CO-R | | 3 CH-O-CO-R + 2KMnO4 + 4H2O —› 3 CH-O-CO-R + 2MnO2 + 2KOH | | CH2-O-CO-(CH2)-CH=CH-(CH2)-CH3 CH2-O-CO-(CH2)-CH-CH-(CH2)-CH3 | | OH OH В результате реакции происходит обесцвечивание раствора перманганата. Опыт №5: омыление жира проходит по схеме ЖИР + КОН = ГЛИЦЕРИН + МЫЛО Алгоритм решения задачи в самостоятельной работе по вариантам : 1) составить уравнение реакции гидролиза жира ; 2) найти массу чистого жира, зная его %-е содержание ; 3) найти массу образовавшегося глицерина по пропорции ; 4) найти массу практическую глицерина, зная его выход. Рекомендации к лабораторной работе № 5. Опыт №1: записать 3 уравнения реакций взаимодействия глюкозы, фруктозы и сахсрозы с гидроксидом меди при встряхивании с образованием глюкозата, фруктозата и сахарата меди василькового цвета (см. схемы в лекции). Эти реакции являются качественными на многоатомность. Опыт №2: глюкоза вступает с гидроксидом меди и аммиачным раствором оксида серебра при нагревании в реакции окисления, идущие по альдегидной группе (см. опыт №2 в Л.Р. №2), с образованием глюконовой кислоты. Эти реакции являются качественными на наличие альдегидной группы в углеводах. Фруктоза является кетогексозой, поэтому в реакцию окисления не вступает. Запишите 2 уравнения реакций. Опыт №3: лактоза является восстанавливающим дисахаридом, поэтому вступает в реакцию с гидроксидом меди при нагревании с образованием лактобионовой кислоты. В результате реакции голубой осадок Cu(OH)2 превращается в красный осадок Cu2O. Альдегидную форму лактозы см. в учебнике Артеменко А.И. на стр.239 (реакция идет по альдегидной группе). Запишите уравнение реакции окисления лактозы. Опыт №4: реакция Панова используется для обнаружения кетогексоз. Опыт №5: сахароза подвергается кислотному гидролизу при нагревании с образованием глюкозы и фруктозы (см. стр. 238 в учебнике Артеменко). Запишите уравнение гидролиза сахарозы. Образовавшуюся глюкозу обнаруживают реакцией с гидроксидом меди при нагревании (см. опыт №2а). Запишите уравнение реакции окисления глюкозы гидроксидом меди. Опыт №6: цветная реакция на сахарозу используется для ее обнаружения. О 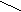 пыт №7: а) схема реакции дегидротации глюкозы с образованием 5-оксиметилфурфурола СН=С-СОН пыт №7: а) схема реакции дегидротации глюкозы с образованием 5-оксиметилфурфурола СН=С-СОН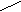 глюкоза —› | О + 3Н2О глюкоза —› | О + 3Н2ОСН=С-СН2ОН б) рассмотреть под микроскопом не только окрашенные йодом крахмальные зерна картофеля, но и крахмальные зерна других растительных культур. Обратите внимание на форму крахмальных зерен пшеницы, риса, манной крупы и др. Опыт №8: ступенчатый гидролиз крахмала идет по схеме н2о н2о н2о (С6Н10О5)n —› (C6Н10О5)у —› n/2 С12Н22О11 —› n С6Н12О6 крахмал декстрины мальтоза D-глюкоза Гидролиз крахмала протекает под влиянием кислот (при кипячении) или ферментов. Реакция гидролиза крахмала под влиянием серной кислоты была открыта русским ученым К.С.Кирхгофом в 1811 г. В настоящее время эту реакцию используют для получения крахмальной патоки - густой сладкой массы, содержащей смесь глюкозы и декстринов. В зависимости от степени гидролиза декстрины дают с йодом окраску от сине-фиолетовой до оранжевой. При глубоком гидролизе крахмала образуется глюкоза, которую обнаруживают реактивом Фелинга (Сu(OH)2 -при нагревании). Алгоритм решения задачи в самостоятельной работе по вариантам : 1) записать 2 уравнения реакций по схемам целлюлоза + Н2О = глюкоза глюкоза —› 2С2Н5ОН + 2СО2 2) найти массу чистой целлюлозы, зная ее %-е содержание; 3) найти массу глюкозы по пропорции; 4) найти массу теоретическую спирта по пропорции; 5) найти массу практическую спирта, зная его выход. Рекомендации к лабораторной работе № 6. Опыт №1: рН аминокислот зависит от количества амино- и карбоксильных групп. Напишите формулы предложенных для опыта аминокислот (см учебник Артеменко, стр. 208) и проанализируйте их строение. Если число групп -NH2 = числу групп -СООН, то рН аминокислоты =7; если число групп -NH2 > числа групп -СООН, то рН > 7(щелочная Среда); если число групп -NH2 < числа групп -СООН, то рН < 7(кислая Среда). Водные растворы моноаминомонокарбоновых кислот имеют нейтральную (рН=7) среду, так как такие аминокислоты в растворе находятся в виде внутренней соли - биполярного иона: + _ NH2 - CH2 - COOH <=> NH3- CH2 - COO биполярный йон Опыт №2: аминокислоты как бифункциональные соединения проявляют двойственные свойства. Схемы реакций, характеризующих взаимодействие АК с минеральными кислотами и щелочами см. на стр. 207 в уч-ке Артеменко А.И. Являясь амфотерными соединениями, аминокислоты имеют большое биологическое значение для поддержания гомеостаза (постоянства внутренней среды) живых организмов. Опыт №3: с гидроксидом меди альфа-аминокислоты образуют устойчивые комплексные соли красно-фиолетового цвета. Схему реакции образования медной соли глицина см. на стр. 207 в уч-ке Артеменко А.И. Опыт №4: биуретовая реакция является качественной на наличие пептидных связей в молекуле белка. Опыт №5: ксантопротеиновая реакция является качественной на наличие в белке ароматических аминокислот. Приведите 2-3 примера ароматических АК, которые могут содержаться в молекуле белка ( см. стр. 208 уч-ка). Опыт №6: денатурация белка - хорошо знакомое явление, которое можно наблюдать при варке куриного яйца. При этом нарушается структура белковой молекулы (четвертичная, третичная, вторичная) и белок теряет биологическую активность. Опыт №7: при действии кислот, щелочей, протеолитических ферментов на белок, он распадается с образованием смеси альфа-аминокислот. Гидролиз протекает ступенчато : белок —› альбумозы (пептоны) —› полипептиды —› дипептиды —› альфа-аминокислоты. Опыт №8: при отравлении солями тяжелых металлов человеку дают выпить сырое яйцо, это способствует нейтролизации действия солей тяжелых металлов. Алгоритм решения задачи в самостоятельной работе по вариантам : 1) составить уравнение реакции этерификации по схеме NH2 -CH2 -COOH + C2H5OH = NH2 -CH2 -COOC2H5 + H2O 2) найти массу чистого спирта, необходимого для этерификации по пропорции; 3) найти массу раствора спирта, зная его %-е содержание; 4) найти объем раствора спирта, зная его плотность. Качественные реакции по распознаванию органических веществ: этанол-------------------- Сu прокал. (CuO)---------------------- запах яблок СН3 -СОН глицерин ----------------- Cu(OH)2 ---------------------- ярко-синий р-р глицерата меди  ---------------- Ag2O -------------------------восстановление серебра из оксида ---------------- Ag2O -------------------------восстановление серебра из оксида альдегид ----------------Cu(OH)2 ---------------------красный осадок Cu2O н  изкомолекулярные ------------ лакмус (м- о)----------раствор красного цвета изкомолекулярные ------------ лакмус (м- о)----------раствор красного цветакарбоновые кислоты ----------- р-р NaOH, FeCI3 ----------раствор красного цвета R-COOH -----------р-р Na2CO3 ----------------выделение СО2 м  уравьиная кислота -----------Ag2O -----------------восстановление серебра из оксида уравьиная кислота -----------Ag2O -----------------восстановление серебра из оксидаН-СООН -----------лакмус --------------- раствор красного цвета -----------р-р Na2CO3 ---------- выделение СО2 С  17Н33СООН --------------------- Br2 ------------------- обесцвечивание 17Н33СООН --------------------- Br2 ------------------- обесцвечиваниеолеиновая к-та ----------------- р-р KMnO4 --------------- обесцвечивание С17Н35СООNa --------------------- H2SO4 ------------------- белые хлопья С17Н35СООН р-р мыла  ------------------------ Cu(OH)2, нагр.--------------- красный осадок Cu2O ------------------------ Cu(OH)2, нагр.--------------- красный осадок Cu2Oглюкоза -------------------------Ag2O ------------------------- восстановление серебра крахмал --------------------------- р-р йода ------------------- синее окрашивание  ----------------- HNO3 ----------------------- осадок желтого цвета ----------------- HNO3 ----------------------- осадок желтого цветабелок яичный ------------------ Сu(OH)2 --------------------красно-фиолетовый цвет Алгоритм решения задачи в самостоятельной работе по вариантам : 1) записать 2 уравнения реакций по схемам фенол + 3Br2 —› 2,4,6-трибромфенол + 3НBr 2этанол + 2Na —› 2этилат Na + Н2 2) найти массу фенола по пропорции; 3) найти массу этанола по пропорции; 4) найти массу смеси. Литература. Основная: 1. Габриелян О.С. Химия -10 (профильный уровень). М.: Дрофа, 2010 г. 2. Артеменко А.И. Органическая химия. М.-”Просвещение”, 1997 г. 3. Потапов В.М. Органическая химия. М.- “Химия”, 1976 г. Дополнительная: 4. Чертков И.Н. Химический эксперимент. М.- “Просвещение”, 1989 г. 5. Смолина Т.А. Практические работы по органической химии. М.- “Просвещение”, 1986 г. 6. Жедек М.С. Лабораторные работы по курсу органической химии. Киев - 1968 г. 7. Нечаев А.П. Органическая химия. М. - “Высшая школа”, 1985 г. 8. Искра О.Ю. Учебные схемы по органической химии. Бутурлиновка. - БМТК |