Учебник для общеобразовательных учебных заведений, автор Габриелян О. С
 Скачать 269.63 Kb. Скачать 269.63 Kb.
|
| Урок по химии в 9 классе на тему: Азот и его свойства. Выполнила: Бочкова Ирина Анатольевна учитель химии МОУ «ССОШ №2» . ПЛАНИРОВАНИЕ ТЕМЫ ПОДГРУППА АЗОТА 1 урок Азот и его свойства. 2 урок Аммиак и его свойства. 3 урок Соли аммония. 4 урок Азотная кислота и её свойства. 5 урок Соли азотистой и азотной кислот. Азотные удобрения Урок «Азот и его свойства» - это первый урок в теме «Подгруппа азота», изучается в 9 классе. Учебник: Химия. 9 класс. Учебник для общеобразовательных учебных заведений, автор Габриелян О.С. Цели и задачи урока Образовательные: Сформировать у учащихся знания: о строении молекулы азота; о физических и химических свойствах азота в связи со строением молекулы; об условиях протекания химических реакций с участием азота; Развивающие: Продолжить работу над формированием у учащихся: умения давать сравнительную характеристику подгруппы, на основании положения её в ПСХЭ, делать выводы об изменении окислительных свойств по подгруппе; навыков частично – поисковой деятельности; умение находить взаимосвязь строения молекулы азота и физических и химических свойств простого вещества; умения рассматривать химические свойства с точки зрения ОВР; умения работать в должном темпе; умения пользоваться справочными материалами. Воспитательные: формировать умение вести диалог, дискутировать, выслушивать друг друга. Оборудование:
«Электроотрицательность элементов»
Ход урока:
Ответ: подгруппа азота составляет V группу главную подгруппы. Она состоит из N; P; As; Sb; Bi. Вопрос: каково строение атомов этих элементов? На основании строении атомов сделайте вывод об изменении окислительных свойств элементов по п/гр Ответ: все атомы элементов данной п/гр имеют 5ē на последнем энергетическом уровне. Для завершения энергетического уровня они будут принимать 3ē и проявлять окислительные свойства. На доске и в тетради рисуются схемы строения атомов:
Вопрос: какие степени окисления будут проявлять данные элементы, и в каком случае? Ответ: элементы п/гр азота могут проявлять положительные и отрицательные степени окисления:
Возможные промежуточные с.о. Например, у азота:
Вопрос: каков состав высших оксидов и водородных соединений элементов п/гр азота; тип химической связи в них. Ответ: Высший оксид Э2О5 – кислотный характер – ковалентная полярная связь ; водородное соединение ЭН3 – ковалентная полярная связь.
а) Рассмотрим строение молекулы самого электроотрицательного элемента азота. Молекула азота состоит из двух атомов. Знаменитый ученый Лавуазье предложил в 1787 г. термин азот, что в переводе с греческого означает «безжизненный». Почему же? Рассмотрим строение молекулы азота. Вопрос: какой тип химической связи в молекуле азота? Ответ: ковалентная неполярная, т.е. твердый N2 будет иметь молекулярную кристаллическую решетку. В   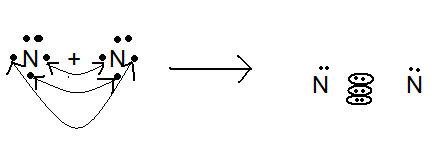 атоме азота на последнем месте энергетического уровня 5ē, из них 3р – электрона свободные образуется между атомами три ковалентные связи молекула азота обладает большой прочностью, что обуславливает его низкую химическую активность. атоме азота на последнем месте энергетического уровня 5ē, из них 3р – электрона свободные образуется между атомами три ковалентные связи молекула азота обладает большой прочностью, что обуславливает его низкую химическую активность.Вопрос: Как подтвердить данный вывод на основании ваших повседневных наблюдений? Ответ: воздух содержит 78% азота и 21% кислорода, но при обычных условиях атмосферные азот и кислород не взаимодействуют. Чтобы азот вступил в реакцию с другими элементами, надо связь между атомами в молекуле разрушить. На разрушение этих связей требуется затратить много энергии, т.к. реакция диссоциации молекулы на атомы эндотермическая: N   2 2N – Q 2 2N – QТ.к. данная реакция обратимая, то можно сместить равновесие в сторону прямой реакции. Вопрос: как это сделать? Ответ: повысить t0 Заметным распад молекулы на атомы становится при температуре выше 3000 0С. Азот по электроотрицательности занимает третье место после O и F. Значит, он должен образовывать прочные соединения с металлами. Но этому противоречит тот факт, что в составе земной коры никаких нитридов не обнаруживается. Вопрос: Представьте себе планету, в химическом составе которой преобладает не кислород, а хлор. А в связи с этим ответьте на вопрос: могут ли войти в состав коры такой планеты бромиды и иодиды? Ответ: нет, не могут, т.к. хлор как более активный будет вытеснять бром и йод из их солей. В таком же положении, в каком на нашей воображаемой планете оказались бы бром и йод, на земном шаре находится азот. Он недостаточно электроположителен, чтобы образовывать прочные соединения с господствующим у нас элементом – кислородом, и недостаточно электроотрицателен, чтобы конкурировать с кислородом в связывании с электроположительными элементами. А теперь вообразите планету, в составе которой кислород и азот поменялись бы местами по сравнению с долей того и другого в составе земного шара. Кора таких планет образована соединениями азота. Второй, по распространенности элемент кремний, содержался бы в ней в виде нитрида, образующего основную ее массу. Вопрос: какова формула этого вещества? Ответ: Si3N4 Это бесцветное вещество, прозрачное, очень твердое и жаропрочное вещество, которое люди производят искусственно и применяют в качестве огнеупорного материала. Горные породы были бы пронизаны золотисто-желтыми кристаллами нитрида алюминия, третьего по распространенности элемента на земном шаре (AlN), а во впадинах коры бушевали бы моря из жидкого аммиака. Такими планетами являются все внешние планеты солнечной системы, начиная с Юпитера, поскольку в их атмосфере обнаружен аммиак. б) Рассмотрим химические свойства азота  N20 +3ē N-3 (c H2 и Me) N20 +3ē N-3 (c H2 и Me)окислитель N  20 -2ē N+2 (c O2) 20 -2ē N+2 (c O2)Восстановитель Азот при повышенной t0 взаимодействует с некоторыми Ме: 6  Li + N2 2Li3N + Q Li + N2 2Li3N + Q3  Mg + N2 Mg3N2 + Q Mg + N2 Mg3N2 + QБолее подробно остановимся на взаимодействии азота с водородом и кислородом. Т.к. обе реакции обратимые (и экзотермические) сравним их и запишем в таблицу.
Более подробно об этих реакциях мы поговорим при изучении производства аммиака и азотной кислоты. с) Для ознакомления с физическими свойствами азота получим его при взаимодействии насыщенных растворов нитрита Na и хлорида аммония.  2H2O 2H2ON    H4Cl + NaNO2 NaCl + NH4NO2 H4Cl + NaNO2 NaCl + NH4NO2N2 Насыщенный раствор NaNO2 (KNO2) 25 г соли в 35 мл воды Насыщенный раствор NH4Cl, 20г в 55 мл воды. Концентрированный раствор нитрита Na приливают из капельной воронки к горячему раствору хлорида аммония (в колбе Вюрца). Скорость реакции регулируется приливанием раствора, реакция протекает спокойно. Азотом наполняют 4 пробирки:
Вопрос: какие физические свойства азота вы можете назвать? Ответ: Физические свойства: бесцветный газ, немного легче воздуха (Dвозд (N2) =Mr(N2)/Mr (возд) = 28/29 =0,97<1 ), малорастворимый в воде ( в 100 объемах воды при обычной температуре растворяется около 2 объемов азота), твердый азот имеет молекулярную кристаллическую решетку (кристаллы имеют малую прочность); tкип = - 196 0C ( а кислорода -183 0С), поэтому для технических целей азот получают при испарении жидкого воздуха, азот улетучивается первым. Закрепление: в качестве закрепления учащимся предлагается выполнить по вариантам следующие задания: I вариант: упр. №2 на стр.111 II вариант: упр. №4 на стр.111 III вариант: упр. №1 на стр.111 Учащиеся сдают тетради с выполненными заданиями на проверку. Ответы: I вариант: N20 + 6Li0 = 2Li3+1N-3 ; Li3N +3H2O = NH3 + 3LiOH ; о↑ в↓ 6ē 1ē 4N-3H3 + 5O20 = 4N+2O-2 +6H2+1O-2 ; 2N+2O-2 + O20 = 2N+4O2-2 ; в↓ о↑ в↓ о↑ 5ē 4ē 2ē 4ē 4N+4O2-2 + 2H2+1O-2 + O20 = 4H+1N+5O3-2 . в↓ о↑ 1ē 4ē II вариант: а) 4N-3H3+1 + 5O20 = 4N+2O-2 + 6H2+1O-2 ; б) 4N-3H3+1 + 3O20 = 2N20 + 6H2+1O-2. в↓ о↑ в↓ о↑ 5ē 4ē 3ē 4ē III вариант: N20 + 3Mg0 = Mg3+2N2-3 ; N20 + 3Ca0 = Ca3+2N2-3 ; N20 + 2Al0 = Al+3N-3 ; о↑ в↓ о↑ в↓ о↑ в↓ 6ē 2ē 6ē 2ē 6ē 3ē Вещества – нитриды; тип химической связи – ионная; тип кристаллической решётки – ионная. Рефлексия урока: Узнали ли вы что-то новое для себя? Что оказалось трудным, что лёгким? Домашнее задание: §23; для I,II вариантов №5 (стр. 111); для III варианта №3 (стр.111); повторить условия образования средних и кислых солей, окислительно- восстановительные реакции. Урок по химии в 9 классе на тему: Аммиак и его свойства. Выполнила: Бочкова Ирина Анатольевна учитель химии МОУ «ССОШ №2» ПЛАНИРОВАНИЕ ТЕМЫ ПОДГРУППА АЗОТА 1 урок Азот и его свойства. 2 урок Аммиак и его свойства. 3 урок Соли аммония. 4 урок Азотная кислота и её свойства. 5 урок Соли азотистой и азотной кислот. Азотные удобрения Урок «Аммиак и его свойства» - это второй урок в теме «Подгруппа азота», изучается в 9 классе. Учебник: Химия. 9 класс. Учебник для общеобразовательных учебных заведений, автор Габриелян О.С. Цели и задачи урока Образовательные: Сформировать у учащихся знания: о строении и составе молекулы аммиака; о физических и химических свойствах аммиака в связи со строением молекулы; об особенностях образования ковалентной связи в ионе аммония; о сущности процесса окисления аммиака; о влиянии условий реакции на полноту окисления вещества; о возможности управления ходом реакции. Развивающие: Продолжить работу над формированием у учащихся: умение находить взаимосвязь строения молекулы аммиака и его физических и химических свойств; умения рассматривать химические свойства с точки зрения ОВР; умения работать в должном темпе; умения пользоваться справочными материалами; навыков частично – поисковой деятельности. Воспитательные: Формировать умение вести диалог, дискутировать, выслушивать друг друга. Оборудование:
к. НС1; 2 полоски фильтровальной бумаги. Ход урока: 1. Опрос:
- нарисовать схему строения атомов N и P. В чем сходство и различие в электронном строении этих атомов, как изменяются окислительные свойства по п/гр; - окислительные и восстановительные свойства азота на примере взаимодействия азота с водородом и кислородом. Сравнить условия протекания этих реакций, дать их характеристики; - домашнее упражнение №3 (стр. 111):   2NO + O2 2NO2 + Q 2NO + O2 2NO2 + QРеакция: гомогенная, обратимая, некаталитическая, экзотермическая, ОВР. Смещение равновесия: а) добавлять исходные вещества, отводить продукт; б) понижать температуру (+ Q) ; в) повышать давление (3V → 2V).
- какой тип связи в молекуле азота? (ковалентная полярная) - в каком виде встречаются азот в природе? (в свободном) - почему в природе больше свободного азота и меньше связанного? (в молекуле азота тройная связь, которая обладает большей прочностью, поэтому молекулярный азот имеет низкую реакционную способность) - как получают азот в промышленности? (ректификацией воздуха) - какие степени окисления характерны для азота? (-3; 0; +1; +2; +3; +4; +5) низшая высшая - какая степень окисления азота в аммиаке NH3? Чем может выступать NH3 в окислительно –восстановительных реакциях? (с.о. -3. т.к. с.о. низшая, то азот может только отдавать ē более электроотрицательным неМе, т.е. будет проявлять восстановительные свойства) 2. Изучение нового материала. Вопрос: почему азот называют элементом, без которого невозможна жизнь? Ответ: азот входит в состав белков, которые являются строительным материалом всех живых организмов. В атмосфере содержится 78% азота, но усваиваться живыми организмами может только химически связанный азот. Техническое решение проблемы «связывания» азота с водородом во многом решило проблему урожайности полей. Понять эту взаимосвязь химии азота и проблем урожая можно, изучив одно из ценных соединений азота – аммиака (нитрид Н). а) Состав и строение молекулы аммиака Вопрос: сколько ē затрачивает атом N на образование связей с атомами Н в молекуле аммиака? Ответ: три ē Вопрос: какого характера связи в молекуле аммиака? Ответ: связи ковалентные полярные. Азот, как более электроотрицательный оттягивает на себя общие ē пары, приобретает с.о. -3 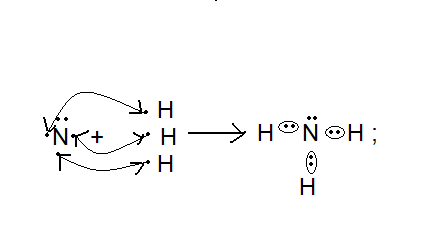 H   +1 N-3 H+1 +1 N-3 H+1 H+1 Молекула аммиака имеет пространственное строение, она представляет собой треугольную пирамиду (тетраэдр), валентный угол 1070, в результате чего молекула аммиака полярна.  1070 . . 1070 . .   N -δ N -δH+δ H+δ    H+δ б) Физические свойства аммиака. Вопрос: какие физические свойства следует ожидать у аммиака, исходя из его состава и строения? Ответ: - это газ, бесцветный, имеет резкий специфический запах - (Mr (возд) = 29; Mr(NH3) = 17 )→ (Dвозд (NH3) = Mr(NH3):Mr(возд) = 17/29 < 1) → (NH3 легче воздуха) → (NH3 собирают методом вытеснения воздуха из пробирки, которая расположена вниз дном). - аммиак летуч →характерен молекулярный тип кристаллической решетки - хорошо растворяется в воде (вещество, имеющее полярные молекулы, хорошо растворяются в полярном растворителе) в 1V(H2O) - до 700V(NH3) при комнатной температуре t0 Аммиак легко снижается, а при испарении жидкого аммиака происходит сильное охлаждение → его применяют в некоторых холодильных установках. Демонстрационный эксперимент – растворение аммиака в воде. К 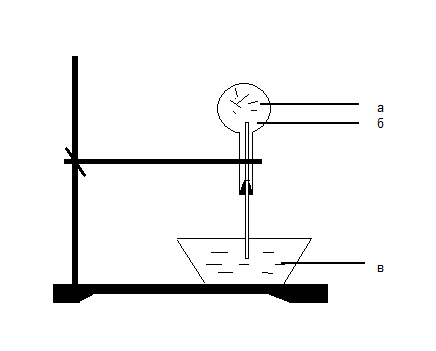 руглодонную колбу наполнить NH3 (б), для этого 10-15 минут пропускать NH3 в колбу. Закрыть колбу пробкой с газоотводной трубкой, конец которой закрыть зажимом. Впустить воду – 1 каплю в (в) колбу → резкое растворение NH3 → фонтан малинового цвета (а), т.к. вода была с небольшим количеством фенолфталеина. руглодонную колбу наполнить NH3 (б), для этого 10-15 минут пропускать NH3 в колбу. Закрыть колбу пробкой с газоотводной трубкой, конец которой закрыть зажимом. Впустить воду – 1 каплю в (в) колбу → резкое растворение NH3 → фонтан малинового цвета (а), т.к. вода была с небольшим количеством фенолфталеина.в) Химические свойства: Для аммиака характерны две группы химических свойств. Первая группа характеризует восстановительные свойства NH3 – это реакции окисления. Вторая группа обусловлена способностью аммиака образовывать ион аммония NH4+. Окисление аммиака. Данная реакция в зависимости от условий идет в разных направлениях. В отсутствии катализатора образуется молекулярный азот и водяной пар.  KMnO4 KMnO4  O2 O2 NH4OH NH4OHНагреть KMnO4 , после начала выделения О2 нагреть NH4OH, поджечь у отверстия пробирки → горение голубым пламенем. Окислительно-восстановительную реакцию учащиеся рассматривают самостоятельно (один ученик у доски). 4N-3H3+1 + 3O20 →2N20 + 6H2+1O-2  О  к-я; в-ль 2N-3 - 6ē →2N0 2 к-я; в-ль 2N-3 - 6ē →2N0 2 В-я; ок-ль 2O0 + 4ē →2O-2 3 4N-3 - 12ē →4N0 6O0 + 12ē →6O-2 При участии: катализатора в зависимости от его состава и других условий (t0; состава исходной смеси, давления) часть аммиака окисляется до оксида N (II) ); В оптимальных условиях удается получить выход NO до 98%. Т.е. применяя тот или иной катализатор можно изменять направление реакции. Поэтому говорят, что катализаторы обладают избирательным действием. Катализаторы – вещества, увеличивающие скорость реакции или меняющие ее направление. Демонстрационный опыт. 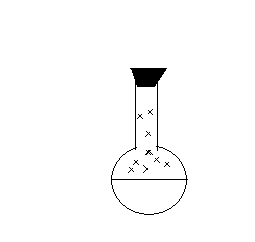 С  r2O3 В качестве катализатора свежеприготовленный Cr2O3 (разложение бихромата аммония (NH4)2 Сr2O7). Нагреть Сr2O3 в ложечке для сжигания веществ, постукивая пальцем по ложечке, всыпать его в колбу – «огненный дождь». r2O3 В качестве катализатора свежеприготовленный Cr2O3 (разложение бихромата аммония (NH4)2 Сr2O7). Нагреть Сr2O3 в ложечке для сжигания веществ, постукивая пальцем по ложечке, всыпать его в колбу – «огненный дождь».Конц. N  H3·Н2О H3·Н2ОУчащиеся рассматривают окислительно-восстановительную реакцию: Сr2O3 4N-3H3+1 + 5O20 →4N+2О-2+ 6H2+1O-2  О  к-я; в-ль N-3 - 5ē →N+2 4 к-я; в-ль N-3 - 5ē →N+2 4 В-я; ок-ль 2O0 + 4ē →2O-2 5 4N-3 - 20ē →4N+2 10O0 + 20ē →10O-2 Химические реакции, связанные с образованием иона аммония. В аммиаке у атома азота имеется неподелённая электронная пара, которая может участвовать в образовании еще одной ковалентной полярной связи между атомами N и катионом водорода (Н+) по донорно-акцепторному механизму:     H+1 + H+1 +. . ↓ H    +1 N-3 H+1 + H+1 → О-2 ← H+1 → H +1 N-3 H+1 + H+1 → О-2 ← H+1 → H  +1 → N-3 ← H+1 + ОН- +1 → N-3 ← H+1 + ОН- ↑ ↑ H+1 H+1H   +1 ион аммония щелочная среда раствора +1 ион аммония щелочная среда раствораПроисходит химическое взаимодействие при растворении NH3 в Н2О – протон от воды перемещается к аммиаку вследствие «перетягивания» его азотом, у которого большая, чем у кислорода, отрицательная с.о. Азот – донор ē пары (от латинского donare – дарить); H+ - акцептор ē пары (acceptor – приемщик).  .. ..N  H3 + Н2+ О H3 + Н2+ О  NH3·H2O гидроксид аммония, нашатырный спирт. NH3·H2O гидроксид аммония, нашатырный спирт.Все четыре ковалентные полярные связи в ионе аммония, независимо от способов их образования, равноценны. Поэтому пространственное строение иона аммония – тетраэдр с атомом азота в центре. Ион аммония – сложный катион, который участвует в реакциях обмена, переходит в новые вещества без изменения. Д
Р    аствор аммиака исследовать с помощью индикаторов: лакмус – синий; фенолфталеин – малиновый; метилоранж – желтый. аствор аммиака исследовать с помощью индикаторов: лакмус – синий; фенолфталеин – малиновый; метилоранж – желтый.В    ывод: раствор аммиака в воде имеет щелочную среду. NH3·Н2О– слабое основание (α = 1,4), пахнет аммиаком. Поэтому можно предположить, что реакция обратимая, что можно доказать на опыте. ывод: раствор аммиака в воде имеет щелочную среду. NH3·Н2О– слабое основание (α = 1,4), пахнет аммиаком. Поэтому можно предположить, что реакция обратимая, что можно доказать на опыте. Демонстрационный опыт: В пробирке нагреть аммиачную воду, к которой предварительно добавить фенолфталеин. Наблюдается исчезновение малиновой окраски, т.к. аммиак улетучивается, а в пробирке остается вода. При нагревании равновесие смещается влево, т.к. с повышением t0 растворимость газов понижается. N   H3 + Н2О NH3·H2O H3 + Н2О NH3·H2O  t0 Этот процесс идет без нагревания медленно, поэтому аммиачная вода пахнет аммиаком. Урок по химии в 9 классе на тему: Соли аммония. Выполнила: Бочкова Ирина Анатольевна учитель химии МОУ «ССОШ №2» ПЛАНИРОВАНИЕ ТЕМЫ ПОДГРУППА АЗОТА 1 урок Азот и его свойства. 2 урок Аммиак и его свойства. 3 урок Соли аммония. 4 урок Азотная кислота и её свойства. 5 урок Соли азотистой и азотной кислот. Азотные удобрения Урок «Соли аммония» - это третий урок в теме «Подгруппа азота», изучается в 9 классе. Учебник: Химия. 9 класс. Учебник для общеобразовательных учебных заведений, автор Габриелян О.С. Цели и задачи урока Образовательные: Сформировать у учащихся знания: о солях сложного катиона – катиона аммония; о качественной реакции на катион аммония; о специфических свойствах солей аммония, обусловленных его строением; Развивающие: Продолжить работу над формированием у учащихся: представления о солях; навыков частично – поисковой деятельности; представлений о качественных реакциях; знаний об общих свойствах солей; умения работать в должном темпе; умения пользоваться справочными материалами. Воспитательные: формировать умение вести диалог, дискутировать, выслушивать друг друга. Оборудование:
- в стаканах подписанных кристаллические соли аммония NH4С1; (NH4)2SO4; NH4NO3; (NH4)2Сr2O7. - в демонстрационной пробирке тв. NH4С1 (2 шт); к. H2SO4; стакан с Н2О; универсальная индикаторная бумагу, демонстрационный штатив, спиртовка, спички, демонстрационный экран (черный), лабораторный штатив.
- тв. NH4С1; (NH4)2SO4; NH4NO3; лакмус, метилоранж; индикаторная бумага универсальная; р. AgNO3; p. NH4С1 - стаканчик с Н2О; спиртовки; спички; держалка для пробирок; 2 лабораторных штатива (один с пробиркой) - в пробирке готовая смесь тв. NH4С1 и Ca(OH)2, пробирка закрыта пробкой. Вопрос: с веществами, какого известного вам класса аммиак должен взаимодействовать так же, как он взаимодействует с Н2О, т.е. с образованием иона аммония? Ответ: с веществами, в молекулах которых содержится слабосвязанные протоны, т.е. с кислотами. Демонстрационный опыт: Две бумажки, смоченные одна аммиачной водой, а другая концентрированной соляной кислотой, сближают. Между ними появляется обильный белый дым – это взвешенные в воздухе мельчайшие твердые частички; значит продукт реакции – твердое вещество. Учащиеся записывают уравнение реакции, определяют, что продуктом реакции является хлорид аммония.  .. ..NH3 + НС1 → NH4С1 г) Применение аммиака и солей аммония. Этот вопрос учащиеся рассматривают самостоятельно, используя рисунок 31 на стр. 115.
Написать реакции взаимодействия NH3 с кислотами. Какие соли и при каких условиях могут образоваться? Дайте названия солям. I вариант: с H3PO4 II вариант: с H2SO4 III вариант: с HNO3 Ответы: I вариант: NH3 + H3PO4 = (NH4)3PO4 фосфат аммония (средняя соль) избыток NH3 + H3PO4 = (NH4)2HPO4 гидрофосфат аммония (кислая соль) недост. NH3 + H3PO4 = (NH4)H2PO4 дигидрофосфат аммония (кислая соль) недост. II вариант: NH3 + H2SO4 = (NH4)2SO4 сульфат аммония (средняя соль) избыток NH3 + H2SO4 = (NH4)HSO4 гидросульфат аммония (кислая соль) недост. III вариант: NH3 + HNO3 = NH4NO3 нитрат аммония (средняя соль)
§ 24; № 1-6 (стр. 115-116) , №5 для I и II вариантов. 1. Ход урока:
1 учащийся: а) Составить уравнение реакции каталитического окисления аммиака (окислительно-восстановительные процессы) б) Написать реакцию растворения аммиака в Н2О 2 учащийся: а) Составить уравнение реакции горения NH3 (окислительно-восстановительные процессы). б) Написать уравнение реакции взаимодействия аммиака с соляной кислотой. 3 учащийся: Объяснить механизм образования катиона аммония. 4 учащийся: Домашнее упражнение №5 (стр. 116) 3Cu+2O-2 + 2N-3H3+1 = N20 + Cu0 + 3H2+1O-2 в↓ о↑ 2ē 3ē Устный опрос - какими физическими свойствами обладает аммиак? (газ, без цвета, с резким запахом; хорошо растворим в воде; легче воздуха). - можно ли осушить аммиак, пропуская его через серную кислоту? (нет, т.к. аммиак взаимодействует с серной кислотой) - как освободить кислород от примесей аммиака? (пропустить через воду; аммиак растворится, а кислород нет). - две банки заполнены газами: первая аммиаком, вторая – водородом. Как узнать в какой банке находится аммиак? (а) взвешиванием – банка с NH3 тяжелее; (б) при внесении горящей лучинки в банку с Н2 раздается хлопок; (в) при внесении влажной фенолфталеиновой бумажки в сосуд с NH3 она станет малиновой) - в двух пробирках находятся растворы NaOH и NH3· Н2О. Как их распознать? (в обе пробирки добавить 1-2 к. фенолфталеина, растворы будут иметь малиновую окраску. Оба раствора нагреть. Т.к. NH3· Н2О нестойкое вещество, оно разлагается и фенолфталеин изменяет свою окраску на бесцветную). - как проверить герметичность сосуда, в котором находится аммиак? (влажная фенолфталеиновая бумажка становится малиновой)
Сегодня мы с вами должны познакомиться с солями аммония. Демонстрация: в стаканах насыпаны кристаллические соли аммония: NH4С1; (NH4)2SO4; NH4NO3; (NH4)2Сr2O7 и др. Это твердые вещества, сходны с другими солями, но более всего с солями щелочных Ме., особенно калия из-за одинакового заряда и близких значений радиуса ионов: R(K+) ≈ R(NH4+) Посмотрим в таблицу растворимости. Она подтверждает, что все соли аммония, как и щелочных металлов, растворимы в Н2О. Соли имеют ионную кристаллическую решетку. Вопрос: чем являются кристаллические вещества, которые имеют ионную кристаллическую решетку и хорошо растворяются в воде? Ответ: они являются сильными электролитами, т.е. в растворе или в расплаве распадаются на ионы. Вопрос: Какие свойства будут характерны для веществ, если они электролиты? Ответ: Эти вещества будут вступать в реакции ионного обмена с другими электролитами, а именно с кислотами, щелочами и другими солями. Подтвердим данные выводы с помощью лабораторных опытов. Опыт 1. для изучения растворимости прилить в пробирку с кристаллической солью 1-2 мл Н2О и размешать содержимое пробирки, встряхивая её: 1 ряд: NH4С1 2 ряд: (NH4)2SO4 3 ряд: NH4NO3 Вопрос: сделайте вывод об общих физических свойствах солей аммония Ответ: соли аммония - тв. кристаллические вещества, белого цвета (если анионы не окрашены), хорошо растворимы в Н2О; t0плав. высокая. В тетрадях и на доске записываются уравнения диссоциации солей. 1  ученик: NH4С1 NH4+ + С1- ученик: NH4С1 NH4+ + С1- 2   ученик: (NH4)2SO4 2NH4+ + SO42- ученик: (NH4)2SO4 2NH4+ + SO42-3  ученик: NH4NO3 NH4+ + NO3- ученик: NH4NO3 NH4+ + NO3- Вопрос: как можно проверить взаимодействуют ли соли аммония с Н2О, т.е. происходит ли гидролиз Ответ: Это можно определить с помощью индикаторов. В тетради и на доске записываются уравнения гидролиза солей. 1   ученик: NH4+ + С1- + Н+ОН- NH3· Н2О + Н+ + С1- ученик: NH4+ + С1- + Н+ОН- NH3· Н2О + Н+ + С1- кислая среда 2   ученик: 2NH4+ + SO42- + 2Н+ОН- 2 NH3· Н2О + 2Н+ +SO42- ученик: 2NH4+ + SO42- + 2Н+ОН- 2 NH3· Н2О + 2Н+ +SO42-кислая среда 3  ученик: NH4+ + NO3- + Н+ОН- NH3· Н2О + Н+ + NO3- ученик: NH4+ + NO3- + Н+ОН- NH3· Н2О + Н+ + NO3- кислая среда кислая средаОпыт 2. Испытать ранее полученные растворы солей индикаторами. Сделать вывод. Ответ: соли аммония подвергаются гидролизу. Опыт 3. Исследуйте, как относятся соли аммония к действию щелочей, на примере хлорида аммония. Для этого готовую смесь тв. хлорида аммония и гидроксида Са нагреть. К отверстию пробирки поднести влажную фенолфталеиновую бумажку. Осторожно исследуйте запах выделяющегося газа. Сделайте вывод об общем признаке реакции между солями аммония и щелочами. Ответ: в результате реакции выделяется аммиак. В тетради и на доске записывается уравнение реакции в молекулярном и ионом виде (если это возможно). t0 2NH4С1 + Са(ОН)2 → СаС12 + 2 NH3↑ + 2 Н2О тв. тв. Ионные уравнения невозможны. Эта реакция может служить качественной для обнаружения иона аммония NH4+ . Т.е. этой реакцией можно пользоваться для решения экспериментальных задач и распознавания минеральных удобрений. Опыт 4: Исследуйте, как относится хлорид аммония к действию других солей, т.е. проведите реакцию на хлорид ион. Сделайте вывод: Ответ: соли аммония взаимодействуют с другими солями, если в результате реакции выпадает осадок. На доске и в тетради записывается уравнение в молекулярном и ионом виде. NH4С1 + AgNO3 → AgС1↓ + NH4NO3 NH4+ + С1- + Ag+ + NO3- → AgС1↓ + NH4+ + NO3- С1- + Ag+ → AgС1↓ Взаимодействие солей аммония с кислотами рассмотрим на демонстрационном опыте. Демонстрационный опыт: К твердому хлориду аммония прилить концентрированную H2SO4. Наблюдается выделение газа – хлороводорода, который можно определить с помощью влажной лакмусовой бумажки – она покраснеет. На доске и в тетради записывается уравнение реакции. 2NH4С1 + к. H2SO4 → (NH4)2SO4 +2НС1↑ тв. Итак, мы рассмотрели общие свойства солей на примере солей аммония: - диссоциация - гидролиз - взаимодействие с кислотами солями щелочами Но у солей аммония есть и особые свойства, которые связаны с разрушением иона аммония. К особым свойствам можно отнести реакцию взаимодействия солей аммония со щелочами, т.к. в ней тоже происходит разрушение иона аммония. Демонстрационный опыт. В пробирке нагревается тв. NH4С1. со временем на дне пробирки кристаллы соли исчезают, а в верхней части пробирки появляется белый налет. При нагревании соль разлагается на аммиак и хлороводород, а на холодных частях прибора NH3 и HС1 снова соединяются с образованием той же соли. Соли аммония, образуемые летучими кислотами, возгоняются: t0 N   H4С1 NH3 + HС1 – процесс обратимый. H4С1 NH3 + HС1 – процесс обратимый.охлажд. Вопрос: будет ли наблюдаться появление белого налета на стенке пробирки при возгонке сульфата аммония, карбоната аммония? Запишите уравнения реакций и сделайте вывод. t0 (NH4)2SO4 → 2 NH3↑ + H2SO4 Ответ: реакция необратимая, т.к. H2SO4 нелетучая, белого налета не будет. t0 (NH4)2СО3 → 2NH3 + СО2↑ + Н2О Ответ: реакция необратимая, т.к. H2СО3 нестойкая и разлагается на СО2↑ и Н2О, белого налета не будет.
В качестве закрепления можно обсудить с учащимися задание, которое подготовит их к последующим практическим занятиям. Задание: составить план распознавания солей хлорида Na; хлорида аммония; сульфата аммония. Запишите уравнения химических реакций. Na+Cl- ; NH4+ С1- ; (NH4+)2 SO42- ↑ ↑ ↑ ↑ ↑ Ag+ OH- Ag+ OH- Ba2+
(NH4)2SO4 + BaCl2 → BaSO4↓ + 2 NH4С1 белый SO42- + Ba2+ → BaSO4↓ t0 тв.NH4С1 +тв. Ca(OH)2 → CaCl2 + NH3↑ + Н2О NaCl + AgNO3 → AgCl↓ + NaNO3 белый Cl- + Ag+ → AgCl↓
а) взаимодействие аммиака с кислотами Демонстрационный опыт. «Дымящие угли» В два стакана наливают к. HС1 и к. NH4OH. Угольки на ниточках опускаются на некоторое время в стаканы (угольки не должны касаться растворов). Угольки адсорбируют пары NH3 и HС1. Затем угольки вынуть из стаканов и привести в соприкосновение, образуется белый дым. NH3 + HС1 → NH4С1 б) нейтрализация гидроксида аммония кислотами Демонстрационный опыт. В демонстрационную пробирку наливается раствор аммиака, добавляется фенолфталеин, который изменяют окраску на малиновую. Затем по каплям добавляется кислота. Полную нейтрализацию определяют по обесцвечиванию фенолфталеина. 2 NH3· Н2О + H2SO4 → (NH4)2SO4 + 2Н2О ф-ф. ↓ 2 ОН- +2Н+ → 2Н2О м  алин. обесцвечивание алин. обесцвечивание
§ 25; I и II варианты: №4,5 III вариант: №1. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
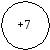
 5ē
5ē 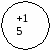 ē
ē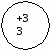
 s ) ) ) )
s ) ) ) )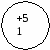
 b ) ) ) ) )
b ) ) ) ) )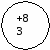 3ē
3ē i ) ) ) ) ) )
i ) ) ) ) ) )

 +3ē Э-3
+3ē Э-3 - 5ē Э+5
- 5ē Э+5 
 2 + O2 2NO
2 + O2 2NO
 пробирка
пробирка