Урок по химии в 8 классе Учитель Ипатова Анастасия Николаевна Тема Ионная связь
 Скачать 40.99 Kb. Скачать 40.99 Kb.
|
| Урок по химии в 8 классе Учитель Ипатова Анастасия Николаевна Тема Ионная связь. Цели урока: объяснить учащимся смысл объединения атомов в молекулы, объяснить что такое ионы и механизм образования ионной связи. Задачи урока: обобщить сведения о строении электронных оболочек атомов в связи с их положением в ПС, оценить валентные возможности атомов при ионном механизме образования ионной связи, научиться выводить формулы бинарных веществ с ионной связью. Тип урока :Комбинированный урок (открытие нового знания). Место проведения: кабинет химии Оборудование: мультимедийная система, шаростержневые модели молекул, ПС с разделением металлов и неметаллов. Ход урока.
Здравствуйте, ребята, садитесь. Сегодня мы узнаем важную «тайну» химических элементов: почему одни атомы могут быть в одиночном состоянии, а другие обязательно объединяются в многоатомные структуры. Какие вещества существуют в виде свободных атомов? (отвечают: благородные газы), а еще в каком виде? (дают определения простым и сложным веществам). Учитель демонстрирует для подсказки модели молекул. А давайте сами выдвинем гипотезу о том, что особенного в благородных газах. Где они находятся в ПС, какие выводы вы сделаете о строении их электронных оболочек? ( Ученики смотрят в ПС и предполагают, что у благородных газов 8 электронов на внешнем слое.). Так, интересно. А давайте-ка проверим вашу правоту, посмотрим в учебнике. (читают §9 учебника О.С. Габриэляна «Изменение числа ē на внешнем энергетическом уровне атомов химических элементов»). Итак, вы правы, а что особенного в таком строении электронной оболочки? 2)Объяснение нового материала. Посмотрите на слайд №1, запишите определение химической связи, ее цель. Запоминаем: такая ē-оболочка из 8-ми ē дает возможный минимум энергии, это то, у чему стремится любая микросистема. А как вы думаете, что может измениться в атоме, если он не благородный газ, а «хочет» иметь такую же оболочку? ( ребята строят предположения, говорят, что скорее всего отдадут или примут ē-ны.) Верно, они действительно отдают или принимают электроны. А кто электроны отдаст, металлы или неметаллы? Почитайте §9, найдите ответ. Ученики говорят, что это атомы металлов. Верно, см. слайд №2. А что меняется тогда у атомов, они что, превращаются в благородные газы? Ученики говорят, что ядра атомов прежние, Значит, сам элемент не меняется, но что-то все-таки новое. Давайте посмотрим на слайд №3. Там изображены атом и ион бериллия. Проверьте, нет ли ошибки в левом рисунке? Ребята смотрят в ПС, изучают состав ядра и ē-оболочку, говорят, что все верно. А какому благородному газу будет «подражать» бериллий, что в нем особенного? ( Ответ: гелию, у него только 2 ē-на). Что же кроме числа ē-нов поменялось у бериллия (ответ: появился заряд). Запишите определение: ион – это атом, у которого неодинаковое число протонов и электронов, сесть электрический заряд. Заряд иона называется степень окисления и равен разности числа протонов и электронов. Давайте теперь оценим атом магния, какой ион он мог бы образовать. Прошу ученика диктовать «рассуждалку» : магний принадлежит 3 периоду 3-ē слоя; принадлежит 2 группе 2ē на внешнем слое легче отдать 2ē до оболочки неона. Mg0-2ēMg+2 Проверяем, смотрим слайд №4 Посмотрите на слайд №5. Что общее, а что разное у ионов? Ребята говорят, что атом водорода берет электроны, приобретает отрицательный заряд, общее то, что электронная оболочка как у гелия. Теперь опишем ион азота. Снова ученик диктует рассуждалку, другие его если надо поправляют : азот принадлежит 2 периоду 2-ē слоя; принадлежит 5 группе 5ē на внешнем слое легче взять 3ē до оболочки неона. N0+3ēN-3 Так, проверяем работу, смотрим слайд №6. 3)Самостоятельная работа на закрепление материала. Теперь попробуйте, глядя в материал учебника, самостоятельно вывести формулу вещества, когда встречаются атомы кальция и хлора. Следуйте алгоритму на стр.37. Вызываю 2 учеников посильнее к доске, остальные работают в классе. Тем, кто в числе первых 5 учеников сделает работу верно, ставлю «5». ( время работы – 7 минут). Итак, проверяем: формула CaCl2. Демонстрация модели молекулы. Проверяем себя , смотрим слайды №7,8,9. 4) Выводы, рефлексия. Сделаем, ребята, выводы: по какому принципу оцениваются валентные возможности атомов и объединяются ионы? (По принципу «отдай-возьми электроны». Сколько отдано-принять ē-нов, столько химических связей образуется).Верно, смотрим слайд№ 10. Запишем, что ионная связь осуществляется за счет притяжения катионов металлов и анионов неметаллов. А вы любите сухой материал учить или с юмором? ( С юмором!) Тогда учим и декламируем стишок мнемонику . Положительные ионы это катионы, а отрицательные – это анионы. Смотрят слайд №11. А теперь честно: что самое трудное в новом материале? (Наверняка ученики отметят, что главное быть внимательным при описании электронных оболочек атомов, не перепутать группу и период). Ну что ж, в следующий раз атомы нам поведают новые тайны. Учитель оценивает работу учеников во время урока, у доски, забирает тетради на проверку с прошлым Д.З.   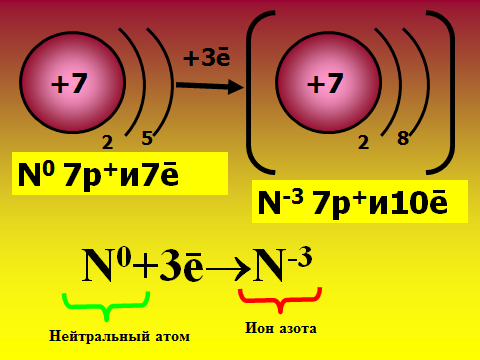 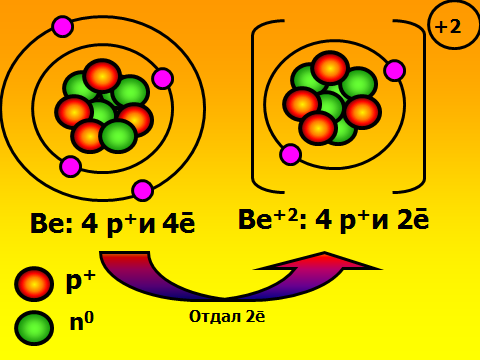 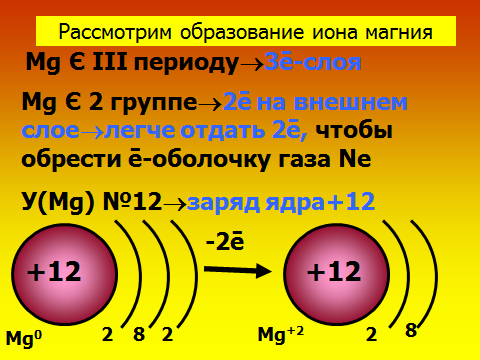 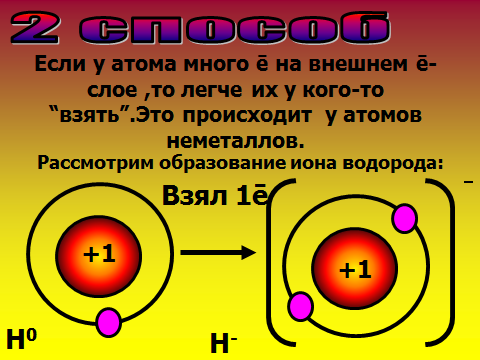  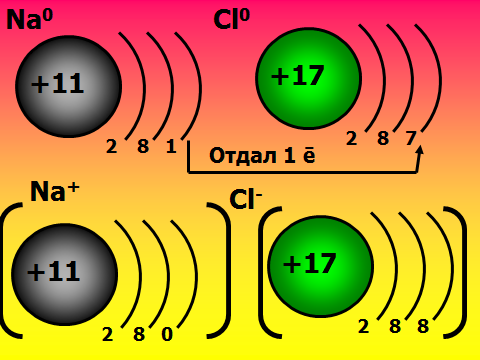  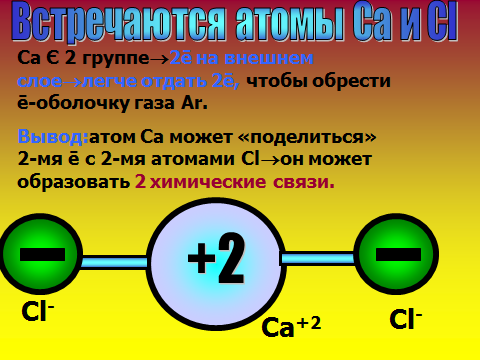  |