Алкены (олефины, этиленовые углеводороды)
 Скачать 138.37 Kb. Скачать 138.37 Kb.
|
| Алкены (олефины, этиленовые углеводороды) CnH2n между атомами углерода одна двойная связь. Номенклатура: ан «ен» или «илен» Вид гибридизации атома углерода: sp2; валентный угол - 120°; λ(С=С) = 0,134 нм; строение: плоское; Изомерия: 1) углеродного скелета; 2) положения двойной связи; 3) межклассовая (циклоалканы); 4) пространственная Ф. св-ва: С2-С4 газы, без цвета; С5-С18 –жидкости; С≥19 –твердые, все мало растворимы в воде Х. св-ва: Активны из-за наличия непрочной π-связи 1) горение: CnH2n + 3n/2 O2 nCO2 + nH2O + Q 2) термическое разложение: : CnH2n nC + nH2 3) Реакции присоединения: Ni
CH2=CH –CH3 + HCl CH3 – CHCl – CH3 (2-хлорпропан) Правило Марковникова: к несимм. алкенам водород присоединяется к более, а галоген к менее гидрированному атому углерода
H3PO4 CH2 = CH2 + HOH CH3 – CH2OH (этиловый спирт, этанол)
Этилен полиэтилен n(CH=CH2) (… CH – CH2-…)n | | CH3 CH3 4) Дегидрирование (отщепление водорода) Cr2O3 CH2=CH – CH3 CHC –CH3 + H2 пропен пропин Cr2O3 CH2=CH – CH3 CH2= C=CH2 + H2 пропен пропадиен Способы получения: 1) Из алканов – дегидрирование: (Cr2O3 – катализатор) CH3 – CH3 CH2=CH2 + H2 2) Крекинг алканов с n6 С10H22 C4H8 + C6H14 3) Дегидратацией спиртов (отщепление воды) Порядок отщепления воды определяется правилом Зайцева: водород отщепляется от менее гидрированного атома углерода. t°140; H2SO4 CH3 – CH2OH CH2=CH2 + H2O 4) Из дигалогенпроизводных: CH3 – CHBr – CH2Br + Zn CH3 – CH =CH2 + ZnBr2 5) Из моногалогенпроизводных со спиртовым раствором щелочи: CH3 – CH2Cl + KOH (спирт) CH2=CH2 + KCl + H2O Алкины (ацетиленовые углеводороды) CnH2n-2 между атомами углерода одна тройная связь. Номенклатура: ан «ин» Вид гибридизации атома углерода: sp; валентный угол - 180°; λ(С=С) = 0,12 нм; строение: линейное; 1 и 2 π связи Изомерия: 1) углеродного скелета; 2) положения тройной связи; 3) межклассовая (алкадиены); Ф. св-ва: С2-С4 газы, без цвета; С5-С16 –жидкости; С≥17 –твердые, все мало растворимы в воде Х. св-ва: характерны реакции присоединения 1) Горение (много С – пламя коптящее) 2C2H2 + 5O2 4CO2 + 2H2O + Q 2) Реакции присоединения: (катализатор:Ni)
CHCH + H2 CH2=CH2 + H2 CH3 – CH3 aцетилен этилен этан
CHCH + Br2 CHBr=CHBr + Br2 CHBr2 – CHBr2 Ацетилен 1,2-дибромэтен 1,1,2,2-тетрабромэтан
CHCH + HCl CH2=CHCl + HCl CH3 – CHCl2 ацетилен винилхлорид 1,1-дихлорэтан
HgSO4 CHC – CH3 + HOH CH3 – C – CH3 пропанон, ацетон || O 3) Тримеризация (для ацетилена) t°, C (уголь) 3 CH CH C6H6 (бензол – ароматический УВ) 4) Замещение водорода у атома углерода с концевой тройной связью: NH3 2CHC –CH3 + Ag2O 2AgCC – CH3 + H2O (качественная реакция на тройную связь) 2CHC –CH3 + 2Na 2Na – C C – CH3 + H2 (слабые кислотные св-ва) 5) окисление а) в кислой среде: CHCH + KMnO4 + H2SO4 HOOC –COOH + MnSO4 + K2SO4 + H2O щавелевая кислота б) в щелочной или нейтральной: CHCH + 8KMnO4 3K2C2O4 + 2KOH + 2H2O + 8MnO2 оксалат калия Предельные одноатомные спирты (алканолы) CnH2n+1OH или R – OH Номенклатура: название углеводорода + ол: этан + ол = этанол Изомерия: 1) углеродного скелета; 2) положения функциональной гидроксильной группы; 3) межклассовая изомерия – простые эфиры: C2H5OH этанол ; диметиловый эфир –межклассовый изомер CH3 – O – CH3 Физ. свойства: даже первый спирт – жидкость; C1-C11 - жидкости, хорошо растворимы в воде, летучи, имеют запах, с C12 – твердые, без запаха, не растворимы в воде, между молекулами возможно образование водородных связей. Химические свойства: 1) горение: CnH2n+1OH + 3n/2O2 n CO2 + (n+1)H2O 2) реакции, идущие с участием водорода в гидроксильной группе:
(сложный эфир: метилацетат) 3) Отщепление ОН-группы (с галогеноводородами)
C2H5OH + HBr C2H5Br + H2O 4) реакции с участием группы «ОН»
C2H5OH + CuO CH3 – COH(альдегид) + Cu + H2O
CH3 – CH(OH) – CH3 + CuO CH3 – C – CH3 + Cu + H2O || ацетон (пропанон) O
C2H5OH CH2 = CH2 + H2O
t°140 H2SO4 C2H5OH + HOC2H5 C2H5 – O – C2H5(диэтиловый эфир) + H2O Получение спиртов: 1) Гидратация алкенов: CH2=CH2 +HOH CH3 –CH2OH 2) щелочной гидролиз галогеналканов C2H5Cl + KOH (водный) C2H5OH + KCl 3) восстановление альдегидов: CH3COH + H2 C2H5OH 4) брожение глюкозы: C6H12O6 2CO2 + 2C2H5OH 5) Из синтез-газа для метанола: CO + 2H2 CH3OH Алканы (предельные,насыщенные углеводороды, парафины) CnH2n+2 между атомами углерода одинарная (-связь) Номенклатура: суффикс: «ан» Вид гибридизации атома углерода: sp3; валентный угол - 109°28; λ(С=С) = 0,154 нм; строение: пространственное; тетраэдрическое Изомерия: 1) углеродного скелета; Ф. св-ва: С1-С4 газы, без цвета; С5-С18 –жидкости; С≥19 –твердые, все мало растворимы в воде Х. св-ва: Малоактивны из-за прочной -связи 1) горение: CnH2n+2 + 3n+1/2 O2 nCO2 + (n+1)H2O + Q 2) термическое разложение: CnH2n+2 nC + (n+1)H2 3) крекинг: разложение алканов с большей массой на алкан и алкен с меньшей массой (n6) t° С6H14 C4H10 + CH2=CH2 гексан бутан этен 4) Изомеризации: получения изомеров: AlCl3 CH3 – (CH2)4 – CH3 CH3 – CH – CH – CH3 гексан | | CH3 CH3 5) Реакции замещения - галогенирования идет по стадиям по радикальному механизму (водород замещается на галоген) Cl h | CH3 – CH – CH3 + Cl2 CH3 – C – CH3 + HCl | | CH3 CH3 2-метилпропан 2-хлор-2-метилпропан 6) Реакции замещения - нитрования идет по стадиям по радикальному механизму (водород замещается на нитрогруппу) - реакция Коновалова NO2 H2SO4 | CH3 – CH – CH3 + HO-NO2 CH3 – C – CH3 + H2O | | CH3 CH3 2-метилпропан 2-нитро -2-метилпропан 7) Реакции дегидрирования: алкан может превратиться в алкен (алкин, алкадиен) Cr2O3 CH3 – CH2 – CH3 CH2 = CH – CH3 + H2 CH C – CH3 + 2H2 CH2=C=CH2 + 2H2 Способы получения: 1) Лабораторный: декарбоксилирование CH3COONa + NaOH CH4 + Na2CO3 Ацетат натрия метан 2) Гидролиз карбида алюминия Al4C3 +12H2O 4Al(OH)3 + 3CH4 3) Реакция, ведущая к удлинению У-В цепи – реакция Вюрца 2CH3Cl + 2Na C2H6 + NaCl 4) Электролиз по Кольбе: 2CH3COONa + 2H2O C2H6 + 2NaOH + H2 + 2CO2 5) Гидрирование непредельных У-В (алкенов, алкинов, алкадиенов) Альдегиды и кетоны CnH2nО или Альдегид Кетон Номенклатура: название углеводорода + «аль»: этан + аль = этаналь; для кетонов: название углеводорода + он: пропан + «он» = пропанон Изомерия: 1) углеродного скелета; 2) межклассовая изомерия: альдегиды кетоны; *3) для кетонов возможна изомерия положения функциональной группы Вид гибридизации атома углерода в карбонильной группе: sp2; валентный угол - 120°; Ф. св-ва: Метаналь – газ, этаналь - летучая жидкость, последующие члены – жидкости, высшие гомологи – твердые вещества. Первые члены гомологического ряда хорошо растворимы в воде. Ацетон – бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях, является хорошим растворителем Химические свойства: 1) реакции восстановления - присоединения (взаимодействие с водородом) Альдегиды превращаются в первичные спирты 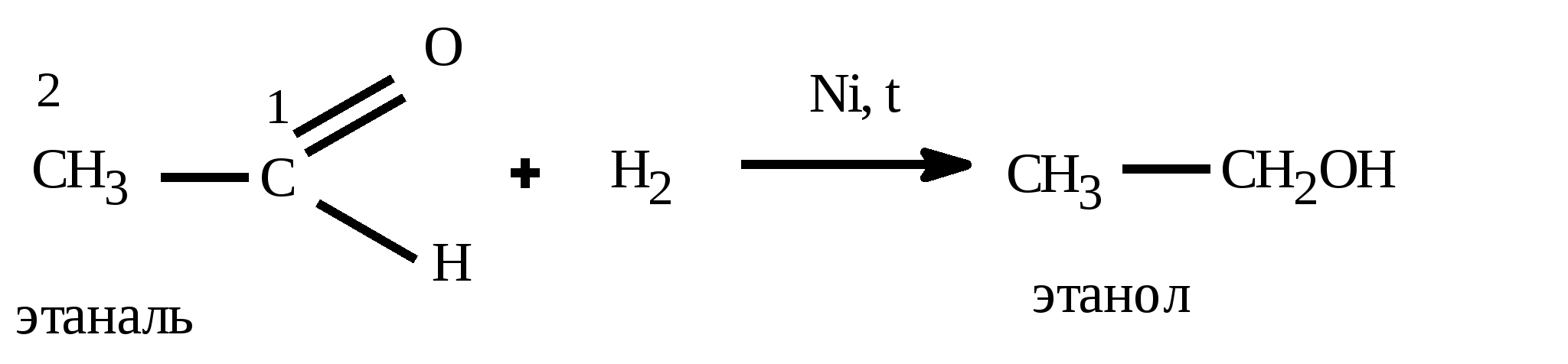 Кетоны превращаются во вторичные спирты 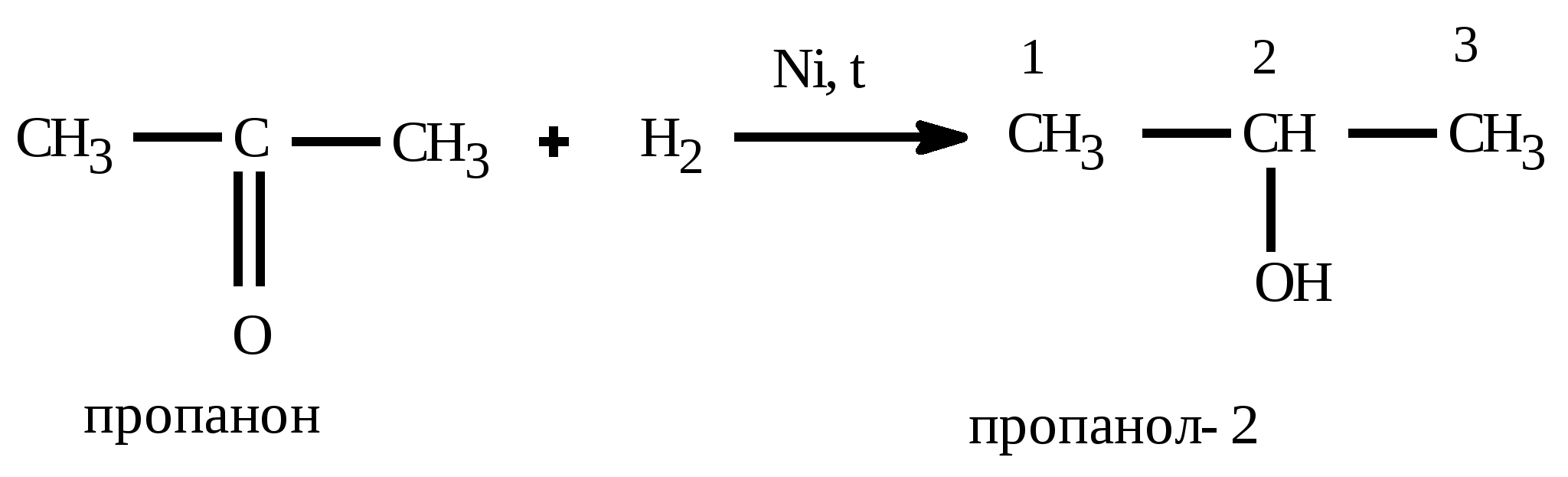 2) Окисление альдегидов в карбоновые кислоты 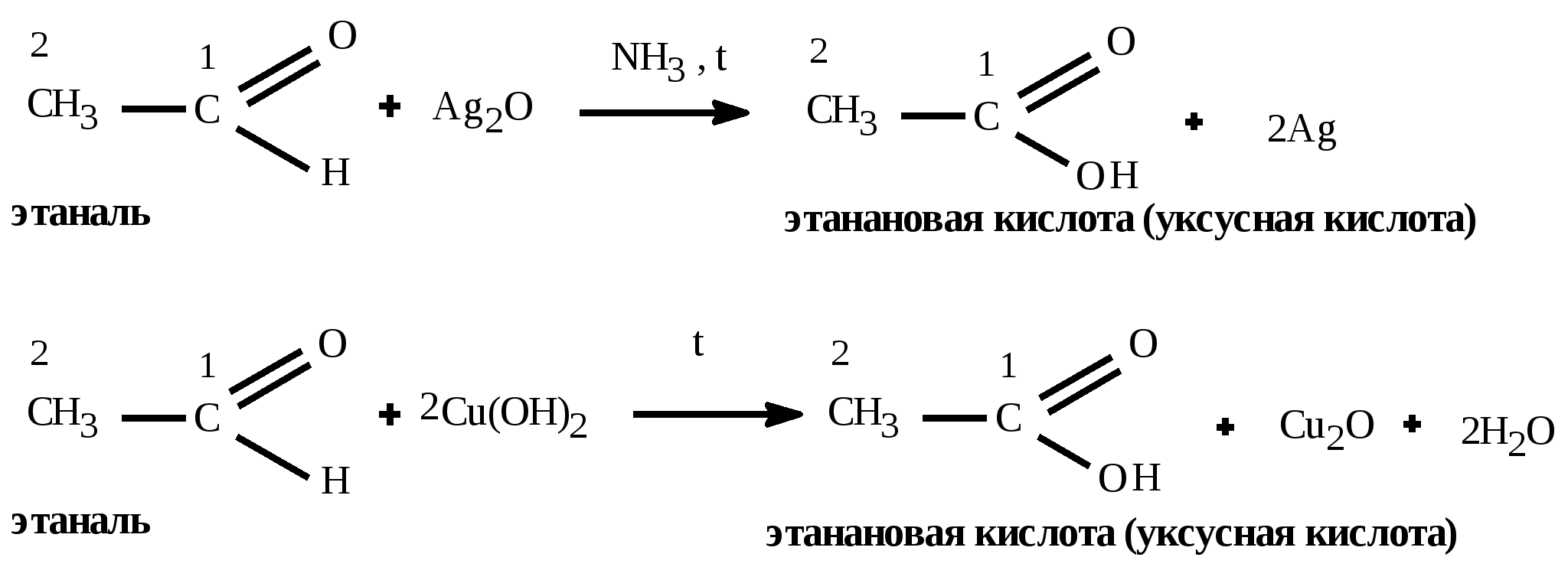 3) Реакции замещения в радикале 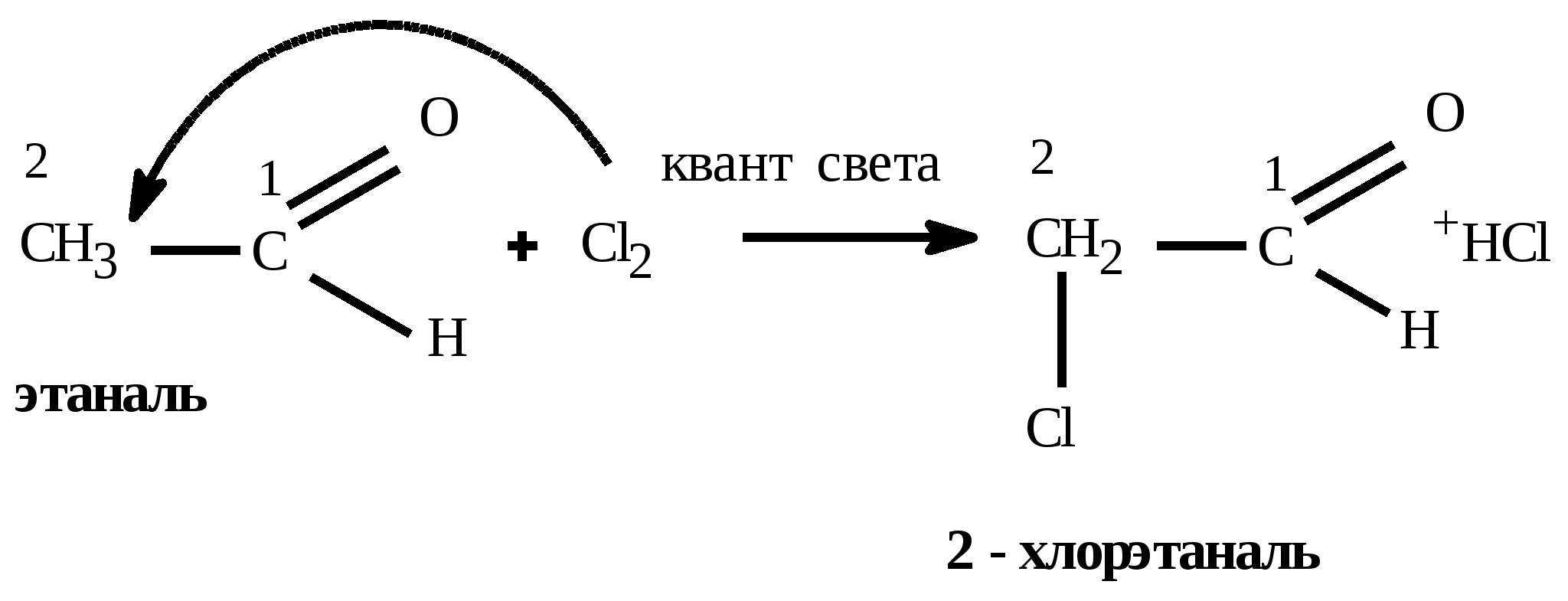 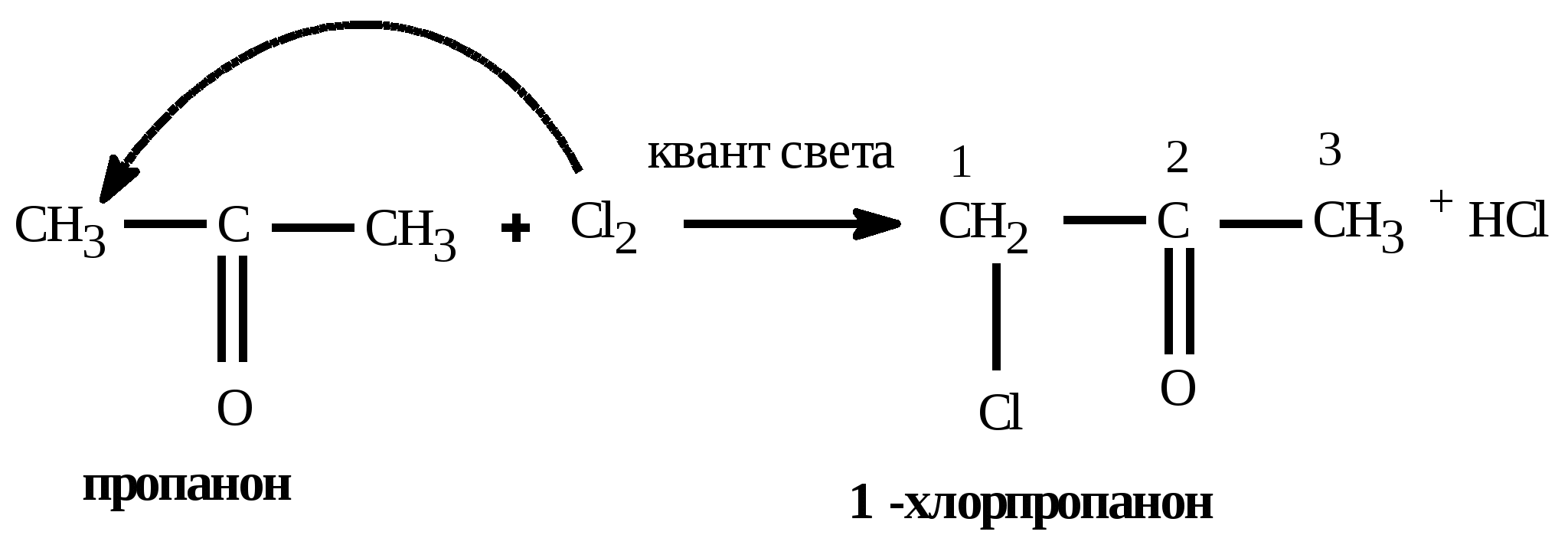 Общие способы получение альдегидов и кетонов:
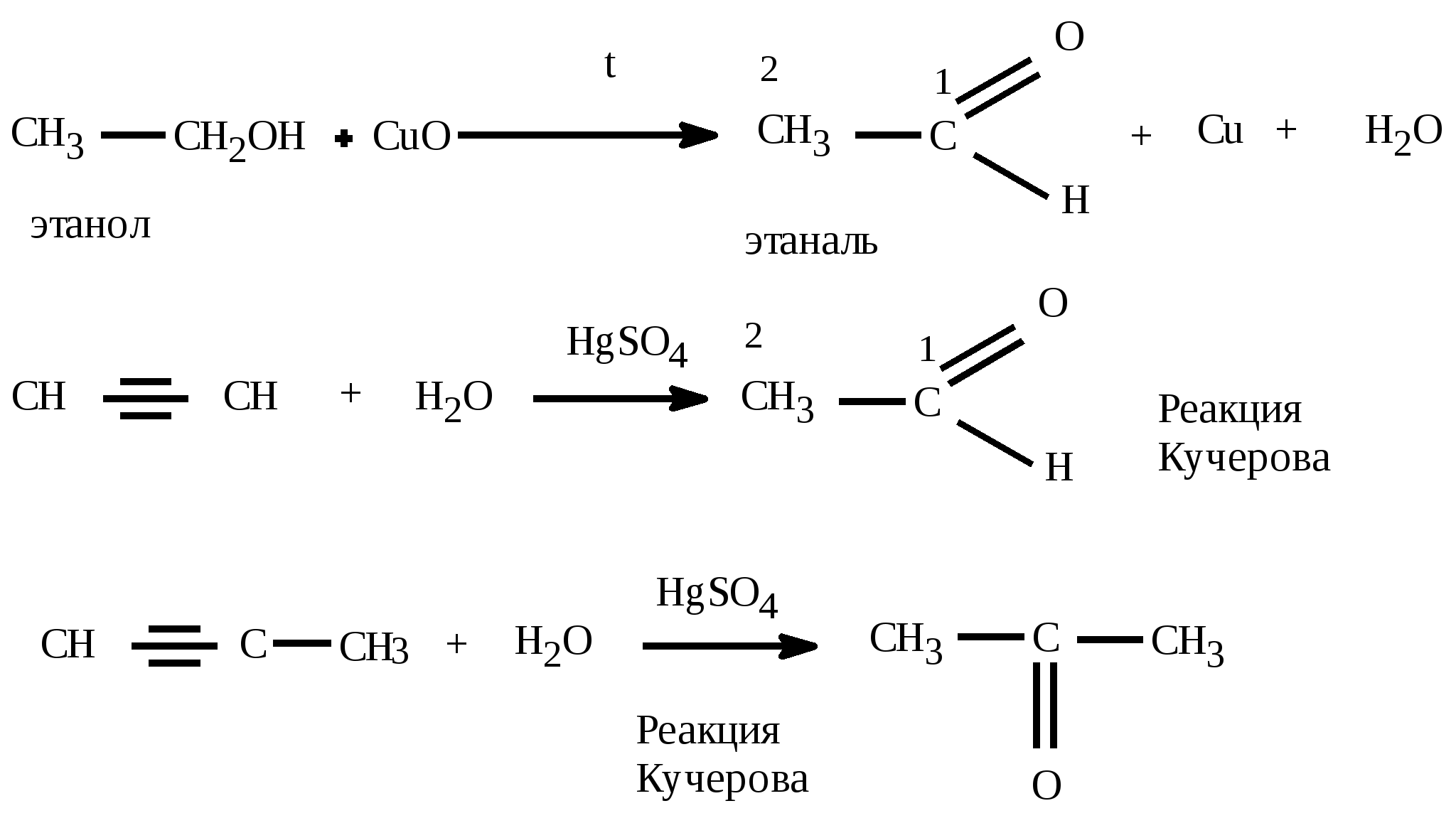
CH4 CH2O + H2O
2CH2=CH2 2CH3 – CHO (катализатор: CuCl2 или PdCl2)
оксосинтез: алкен + СО(угарный газ) + Н2 альдегид CH2 =CH2 + CO + H2 CH3 – CH2 – CHO
CH3 – CHCl2 + 2NaOH CH3 – CHO + H2O + 2NaCl |
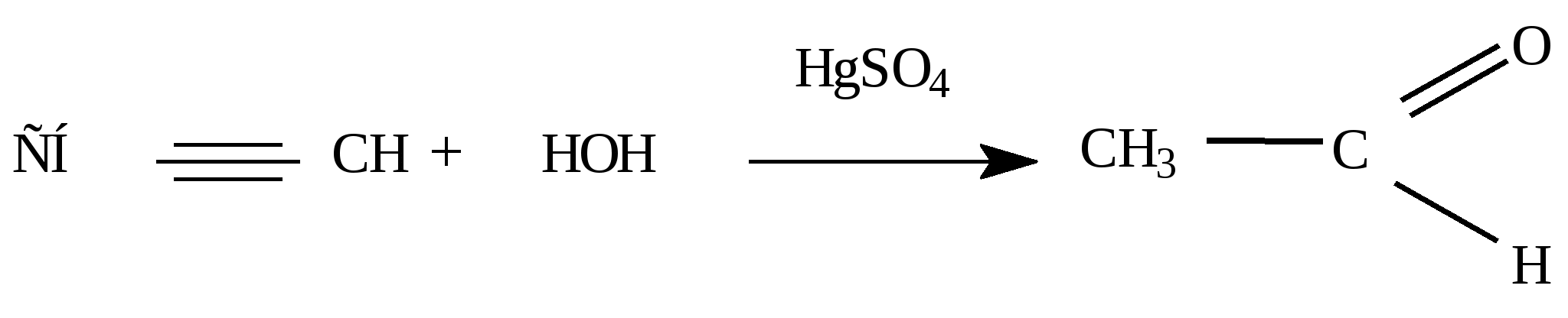 омологи алкинов дают кетоны:
омологи алкинов дают кетоны: