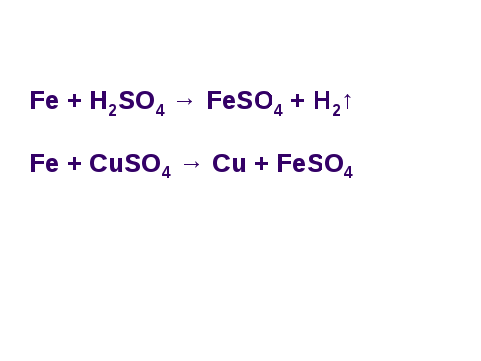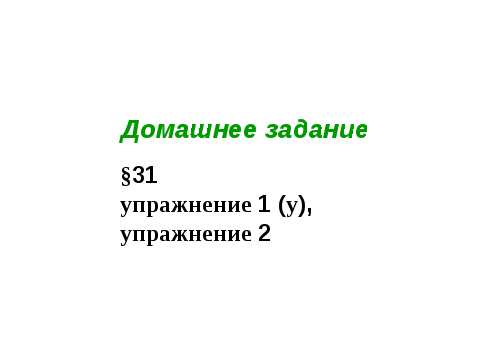|
Разработка урока №3 «Реакции замещения» в теме «Типы химических реакций» гбоу сош №544 Костина Е. П. Тема урока : Реакции замещения Тип урока: Урок изучения нового материала Цели и задачи урока
Разработка урока № 3
«Реакции замещения»
в теме «Типы химических реакций»
ГБОУ СОШ № 544
Костина Е.П.
Тема урока:
Реакции замещения
Тип урока: Урок изучения нового материала
Цели и задачи урока:
Обучающие:
Дать понятие о реакциях замещения;
Продолжить формирование умения записывать уравнения химических реакций;
Закрепить на уравнениях химических реакций знание химической номенклатуры, умение расставлять коэффициенты;
Дать понятие о ряде активности металлов;
Изучить условия взаимодействия металлов с растворами кислот и солей.
Развивающие:
Развивать познавательную активность, умение наблюдать окружающий мир, задумываться над причинами его изменения;
Раскрыть связь между химическими знаниями и повседневной жизнью человека.
Совершенствовать навыки само – и взаимопроверки.
Воспитательные:
Воспитывать культуру речи, поведения. Прививать интерес к химии.
Планируемые результаты (учащиеся должны):
знать определение «реакции замещения»;
уметь определять исходные вещества и продукты реакции;
уметь расставлять коэффициенты;
уметь выделять признак, на основании которого реакцию относят к реакции замещения;
уметь наблюдать химический эксперимент и делать правильные выводы на основании наблюдения.
Ход урока
Содержание
|
Методы и методологические приёмы, приборы, оборудование
|
I Организационный момент
II Изучение нового материала
Информационный ввод учителя
Вспомним типы реакций, которые мы изучили
(реакции соединения и разложения).
В чём заключается суть этих реакций?
Сегодня на уроке мы познакомимся с новым типом химических реакций – реакции замещения. Рассмотрим суть данных реакций, условия их протекания и самостоятельно сформулируем определение «реакции замещения».
Слайд 2

Взаимодействие металла с кислотой
Предлагаю вам посмотреть демонстрационный эксперимент, в ходе которого необходимо заполнить следующую схему – «ёлку»
Слайд 3
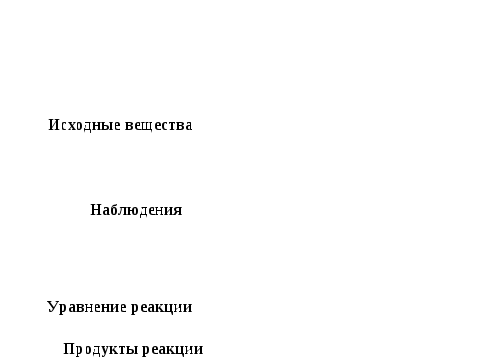
Zn + HCl
  Исходные вещества Исходные вещества
Наблюдения
  Уравнение реакции Уравнение реакции
Продукты реакции
Д.О.:
Z n + HCl n + HCl 
Какие продукты реакции образуются в результате взаимодействия металла и кислоты? (водород и соль)
Все ли металлы взаимодействуют с кислотами?
Предлагаю вам следующий эксперимент:
Д.О.:
Са Mg Zn Cu
   
HCl
Какой вывод вы можете сделать?
(металлы по – разному реагируют с кислотами, некоторые металлы с кислотами не реагируют)
Для прогнозирования возможности протекания реакций между кислотами и металлами обратимся к ряду напряжений металлов.
Какая «особенность» в ряду напряжений МЕТАЛЛОВ вам показалась странной?
(наличие водорода)
Найдите в ряду напряжения те металлы, которые реагировали с соляной кислотой в эксперименте. Где они стоят относительно водорода?
Найдите в ряду напряжений металл, не прореагировавший с кислотой. Каково его место в ряду напряжений относительно водорода?
Сделайте вывод на основе ваших наблюдений.
С кислотами взаимодействуют металлы, стоящие в ряду напряжений до водорода
Уравнения реакций:
Ca + 2HCl → CaCl2 + H2↑
Mg + 2HCl → MgCl2 + H2↑
Z n + 2HCl → ZnCl2 + H2↑ n + 2HCl → ZnCl2 + H2↑
Cu + HCl →
Взаимодействие металлов с солями
Ряд активности металлов также можно использовать для прогнозирования возможности протекания реакций между металлами и солями
Обратимся к эксперименту:
Д.О.:
Нитрат Сульфат Сульфат Нитрат
магния цинка меди серебра
   
Zn Zn Zn Zn
В каких пробирках прошла реакция?
Напишите уравнения реакций.
Используя ряд активности металлов и результаты эксперимента, сделайте вывод о условиях взаимодействия металла с солью
Свободный металл должен располагаться в ряду напряжения металлов левее металла, входящего в состав соли
Уравнения реакций:
Zn + CuSO4 = Cu + ZnSO4
Zn + 2AgNO3 = 2Ag + Zn(NO3)2
Реакции замещения – это реакции, в которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
III Первичное закрепление
Даны вещества: железо, золото, серная кислота, сульфат меди (II), сульфат железа (II), - напишите уравнения возможных реакций.
Слайд 4

Слайд 5
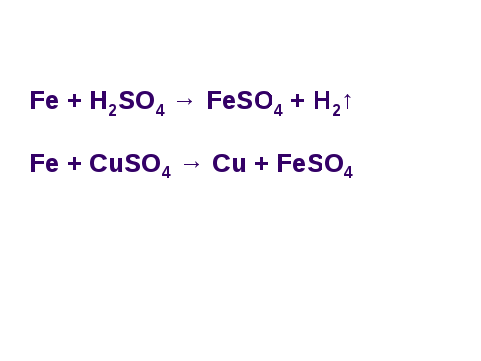
IV Рефлексия
Выберите квадратик определённого цвета
Красный - я активен и уверен на уроке,
Жёлтый - я чувствовал себя неуверенно, работал мало;
Зелёный - у меня возникло много вопросов, мне есть, над чем поработать дома...
Слайд 6

V Домашнее задание
§31, упражнение 1 (у), упражнение 2
Упражнение 1
Какие реакции называются реакциями замещения? Сравните их с реакциями соединения и разложения.
Упражнение 2
Запишите уравнения следующих реакций замещения:
А) оксид железа (III) + алюминий →
Б) оксид железа (III) + водород →
В) хлорид меди (II) р- р + алюминий →
Г) оксид свинца (IV) + углерод →
Д) бромид железа (III) р – р + хлор →
Слайд 7
|
Беседа с классом, запись темы урока в рабочую тетрадь
Демонстрационный опыт (цинк, соляная кислота)
Можно использовать Оверхет проектор, опыт проводить в чашке Петри
Анализ объектов с целью выделения признаков
Приём «Ёлка»
Заполнение схемы, учитель – организатор, один из учеников – проверяющий
Записи в тетради
Беседа с классом
Постановка проблемного вопроса
Демонстрационные опыт (соляная кислота, кальций, магний, цинк, медь)
Записи в тетради
Работа с рядом активности металлов
Выделение признаков, формирование выводов на основе эксперимента
Записи в тетради, запись уравнений возможных реакций
Работа с рядом активности металлов
Демонстрационные опыт (цинк, нитрат магния, сульфат цинка, сульфат меди, нитрат серебра)
Выделение признаков, формирование выводов на основе эксперимента
Записи в тетради, запись уравнений возможных реакций
Подведение под понятие. Самостоятельная формулировка определения.
Самостоятельное выполнение упражнения, само – или взаимопроверка
| |
|
|
 Скачать
Скачать
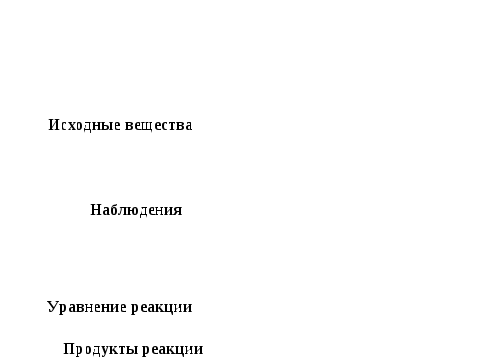



 Исходные вещества
Исходные вещества

 Уравнение реакции
Уравнение реакции n + HCl
n + HCl 

 n + 2HCl → ZnCl2 + H2↑
n + 2HCl → ZnCl2 + H2↑