Конспект занятия Предельные углеводороды, их строение, изомерия и номенклатура
 Скачать 69.86 Kb. Скачать 69.86 Kb.
|
| Конспект занятия Предельные углеводороды, их строение, изомерия и номенклатура Единый план изучения всех классов органических соединений:
1. Алканы – это углеводороды (УВ), в молекулах которых все атомы углерода связаны между собой одинарными связями, а все остальные валентности насыщенны атомами водорода до предела, т.е. соединены с максимально возможным числом водорода. Поэтому алканы называют предельными УВ, насыщенными УВ, а также парафинами (что означает «малое сродство»).
Если все формулы алканов расположить в один столбик в порядке увеличения количества атомов углерода, то можно составить особый ряд УВ и увидеть в нем определенные закономерности. 2. Гомологический ряд.
Во-первых, первые четыре УВ в этом ряду называются метан, этан, пропан и бутан. Названия следующих представителей формируются от названий греческих числительных, указывающих число углеродных атомов в молекуле: 5 – «пента», 6 – «гекса», 7 – «гепта», 8 – «окта», 9 – «нона», 10 – «дека». Во-вторых, для всех предельных УВ характерным признаком в названии является суффикс –ан. В-третьих, каждый последующий представитель данного ряда отличается от предыдущего на один атом углерода и два атома водорода, т.е. СН2. Такой ряд называется гомологическим рядом предельных УВ. Гомологический ряд – это ряд органических веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по Гомологи – вещества этого ряда, или органические вещества, сходные по строению, но отличающиеся друг от друга по составу на одну или несколько групп – СН2 -. Группа – СН2 – называется гомологическая разность. Гомологические ряды характерны для всех классов органических веществ. 3. Особенности электронного и пространственного строения. У атома углерода в стационарном состоянии на внешнем энергетическом уровне находятся два спаренных s-электрона и два неспаренных p-электрона, т.е. в данном случае углерод способен образовать только две валентные связи (по количеству неспаренных электронов). В органических соединениях углерод всегда проявляет валентность, равную четырем. Это происходит из-за того, что атом углерода переходит в возбужденное состояние, т.е. его один s-электрон переходит на p-орбиталь, и вместо двух неспаренных электронов появляется четыре.  Можно предположить, что связи, образованные одним s-электроном и тремя p-электронами, должны отличаться друг от друга по длине, энергии, а следовательно, и прочности, потому что s-электрон имеет сферическую форму, а p-электроны – форму объемной восьмерки. Тем не менее, расчет электронной плотности в кристаллах метана показывает, что все связи в его молекуле равноценны и направлены к вершине тетраэдра. Это объясняется тем, что при образовании молекулы метана ковалентные связи возникают за счет взаимодействия не обычных орбиталей, а так называемых гибридных, т.е. усредненных по форме и размерам. Процесс выравнивания орбиталей по форме и размерам называется гибридизацией. Число гибридных орбиталей равно числу исходных орбиталей. По сравнению с ними гибридные орбитали имеют вид вытянутых в одну сторону объемных восьмерок, что обеспечивает их более полное перекрывание с орбиталями соседних атомов.                 + + В молекуле метана и в других алканах, а также во всех органических молекулах по месту одинарной связи атомы углерода будут находиться в sp3-гибридизации, так как у атома углерода гибридизации подверглись один s-электрон и три p-электрона. У всех четырех гибридных электронов энергия равная, все они имеют отрицательный заряд, и поэтому стремятся оттолкнуться своими выпуклыми частями друг от друга как можно дальше и на равное расстояние. Это возможно только в том случае, если оси гибридных орбиталей будут располагаться друг по отношению к другу под углом 109°28'.  В 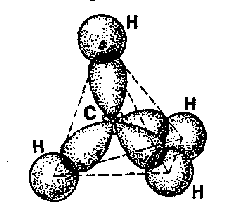 ытянутые части гибридных sp3-орбиталей будут образовывать связи с атомами водорода, поэтому форма молекулы метана - тетраэдр, в углах которого расположены атомы водорода, а ядро атома углерода находится в центре тетраэдра. ытянутые части гибридных sp3-орбиталей будут образовывать связи с атомами водорода, поэтому форма молекулы метана - тетраэдр, в углах которого расположены атомы водорода, а ядро атома углерода находится в центре тетраэдра.При присоединении к гибридным орбиталям атома углерода электронных орбиталей атома водорода или другого атома углерода, электронные облака будут перекрываться по линии, соединяющей центры атомов (линии связи) Такая связь называется σ-связь. σ-Связь – это связь, образованная в результате перекрывания электронных орбиталей вдоль линии связи. Данная связь является разновидностью ковалентной малополярной связи. 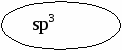          С Н С С С Н С С     s s s s   0,154 нм Длина углерод-углеродной связи в предельных УВ равна 0,154 нм (1 нм = 10-9м) 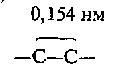 Связи С – Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т.е. связь С – Н является слабополярной. Молекулы других алканов, начиная с пропана, будут иметь зигзагообразную форму, т.к. связи между соседними атомами углерода также будут располагаться под углом 109°28'.  Поскольку соседние атомы углерода связаны простой (одинарной) связью, то возможно свободное вращение вокруг связи С – С. Вследствие этого зигзагообразная цепь может принимать различные пространственные формы. 4. Виды изомерии и номенклатура Из всех видов изомерии для предельных УВ характерна только структурная изомерия и ее разновидность - изомерия углеродного скелета . Кроме того, для галогензамещенных УВ характерна еще одна разновидность структурной изомерии – изомерия положения заместителей. Изомерию мы будем рассматривать совместно с номенклатурой. Номенклатура – система названий, употребляемая в какой-либо науке. Она может быть: - тривиальная – исторически сложившиеся названия; - рациональная – в основе лежит название простейшего соединения; - систематическая (международная, ИЮПАК) - основой для названия служит одна основная углеродная цепь атомов. Мы будем пользоваться систематической номенклатурой, которая используется во всем мире. Алгоритм составления названий по систематической номенклатуре:
Пример. Назвать вещества, структурные формулы которых приведены ниже, найти среди них изомеры. 1) СН3 ׀ 1СН3 – 2С – 3СН – 4СН3 2,2,3-триметилбутан ׀ ׀ 3СН 3НС (2 6СН3 – 5СН2 – 4СН2 – 3СН – 2СН – 1СН3 2–метил–3-этилгексан ׀ ׀ СН2 СН3 ׀ СН3 3) СН3 ׀ 1СН3 – 2СН – 3СН – СН3 2,3-диметилпентан ׀ 2СН4 ׀ 5СН3 4) СН3 ׀ 1СН3 – 2С – 3СН2 – 4СН – 5СН3 2,2,4-триметилпентан ׀ ׀ СН3 СН3 5) 7СН3 – 6СН2 – 5СН – 4СН2 – 3СН – 2СН2 3–метил–5-этилгептан ׀ ׀ ׀ СН2 СН3 1СН3 ׀ СН3 Изомерами являются вещества 1 и 3, так как им соответствует общая молекулярная формула С7Н16, т.е. состав их одинаков, а строение – разное. Главный вывод занятия:
|