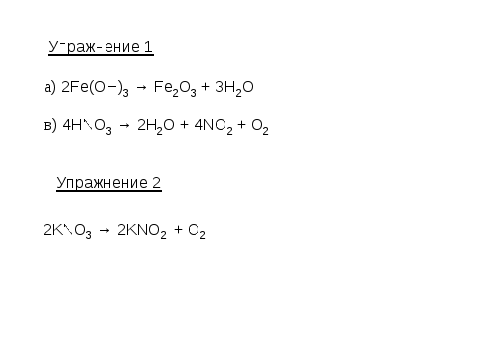|
Разработка урока №1 «Реакции разложения» в теме «Типы химических реакций» гбоу сош №544 Костина Е. П. Тема урока : Реакции разложения Тип урока: Урок изучения нового материала Цели и задачи урока: Обучающие
Разработка урока № 1
«Реакции разложения»
в теме «Типы химических реакций»
ГБОУ СОШ № 544
Костина Е.П.
Тема урока:
Реакции разложения
Тип урока: Урок изучения нового материала
Цели и задачи урока:
1. Обучающие:
Дать понятие о реакциях разложения;
Продолжить формирование умения записывать уравнения химических реакций;
Закрепить на уравнениях химических реакций знание химической номенклатуры, умение расставлять коэффициенты;
Закрепить понятия: «исходные вещества», «продукты реакции»;
2. Развивающие:
Развивать познавательную активность, умение наблюдать окружающий мир, задумываться над причинами его изменения.
Раскрыть связь между химическими знаниями и повседневной жизнью человека;
Совершенствовать навыки само – и взаимопроверки.
3. Воспитательные:
Воспитывать культуру речи, поведения. Прививать интерес к химии.
Планируемые результаты (учащиеся должны):
знать определение «реакции разложения»;
уметь определять исходные вещества и продукты реакции;
уметь расставлять коэффициенты;
выделять признак, на основании которого реакцию относят к реакции разложения.
Ход урока
Содержание
|
Методы и методологические приёмы, приборы, оборудование
|
I Организационный момент
II Изучение нового материала
Информационный ввод учителя
Сегодня на уроке вам предстоит познакомиться с первым типом химических реакций – реакциями разложения.
Одной из главных задач сегодняшнего урока перед вами является самостоятельно сформулировать определение реакции разложения.
Давайте запишем на доске ваши предположения.
Слайд 2
Изучение нового материала
Слайд 3
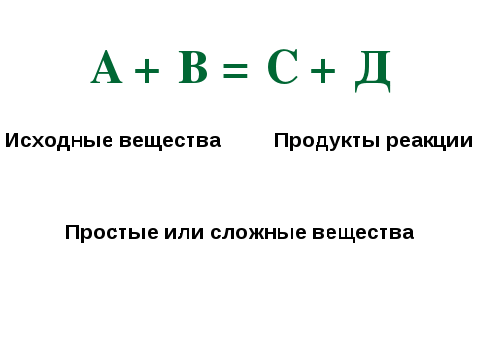
Перед вами схема химической реакции:
А + В = С + Д
Из чего состоит уравнение реакции? (исходные вещества, продукты реакции, коэффициенты)
Исходные вещества, продукты реакции (вещества) – на какие типы они делятся? (простые и сложные)
Предлагаю вам, проанализировав уравнение предложенной реакции, заполнить «древо предсказаний» Слайд 4

  
 Прогноз Т Прогноз Прогноз Т Прогноз
 Е Аргументы Е Аргументы
Аргументы М
А
1-я реакция:
В 1774 г. английский химик Дж. Пристли, используя стеклянную двояковыпуклую линзу, направил пучок солнечных лучей на оксид ртути (II) и получил кислород.
Запишем уравнение этой химической реакции.
2HgO = 2Hg + O2
Слайд 5
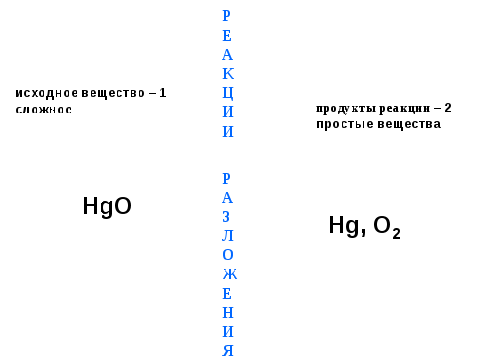
2-я реакция:
В промышленности разложение известняка (карбоната кальция) используют для получения негашёной извести (оксида кальция)
CaCO3 = CaO + CO2
Слайд 6
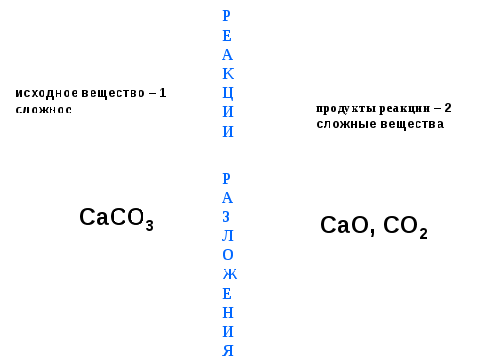
3-я реакция:
Одним из способов получения кислорода является разложение перманганата калия KMnO4
Запишем уравнение реакции
2KMnO4 = K2MnO4 + MnO2 + O2
Слайд 7
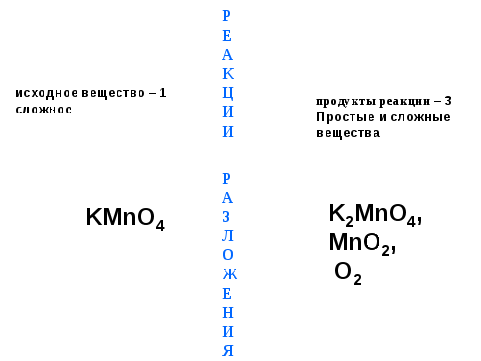

  продукты реакции - 2 продукты реакции - 2
исходное вещество -1 Р простые вещества
  сложное Е сложное Е
А
К Hg, О2 продукты реакции Hg, О2 продукты реакции
HgO Ц  2 2
исходное И
вещество -1 И сложные
сложное Р
СаСО3 А СаО, СО2 СаО, СО2
З  продукты продукты
исходное Л реакции реакции
вещество О - 3
-1 Ж сложные
KMnO4 Е K2MnO4, и
сложное Н MnO2, простые
И О2
Я
Определение – «реакции разложения»
Исходя из заполненной схемы, сформулируйте определение понятия «реакции разложения»
Слайд 8

Реакции разложения – реакции, в результате которых из одного сложного вещества образуется два и более новых веществ.
Катализаторы, ферменты
Инструктаж по ТБ
Запрещается ходить во время урока, загромождать проходы портфелями;
Будьте внимательны при работе с химическими реактивами
Запрещается пробовать вещества на вкус;
Запрещается смешивать вещества без разрешения учителя;
После окончания работы приведите рабочее место в порядок.
Слайд 9

Л.О.: Получение кислорода из пероксида водорода
Слайд 10

Ход выполнения
1
|
Наблюдение
|
Ход выполнения
2
|
Наблюдение
|
Вывод
|
Налить в пробирку пероксид водорода;
Нагреть, не доводя до кипения;
Внести тлеющую лучинку.
|
|
Налить в химический стакан на 1/3 пероксида водорода;
Аккуратно всыпать немного порошка оксида марганца (IV);
Внести в верхнюю часть стакана тлеющую лучинку
|
|
|
Ход выполнения
1
|
Наблюдение
|
Ход выполнения
2
|
Наблюдение
|
Вывод
|
|
Лучинка загорается через некоторое время
|
|
Вспыхивание лучинки практически мгновенно
|
В опыте № 2 скорость реакции больше, чем в опыте №1
|
Мы научились управлять скоростью химической реакции разложения пероксида водорода.
2Н2О2 = 2Н2О + О2
Обратите внимание, в уравнении реакции нет MnO2, что это значит? (вещество ускоряет химическую реакции, оставаясь к концу реакции неизменным)
Вы только что дали определение «катализатор», запишите его в тетрадь.
Катализатор – вещество, ускоряющее химическую реакцию, но само в ней не участвующее.
Вспомните, в каких случаях вы используете перекись водорода дома? (обеззараживание раны)
Бурно ли выделяется кислород при этом? (да)
Какой вывод вы можете сделать? (в крови есть катализатор)
Биологические катализаторы белковой природы называют ферментами.
Слайд 11

III Первичное закрепление
Слайд 12

Выполнить упражнения:
Учебник стр. 29, упр. 1 (а,в);
Запишите уравнения реакций разложения, схемы которых:
а) Fe(OH)3 → Fe2O3 + H2O
в) HNO3 → H2O + NO2 + O2
Запишите уравнение реакции разложения нитрата калия, если в результате образуется нитрит калия и кислород
Слайд 13
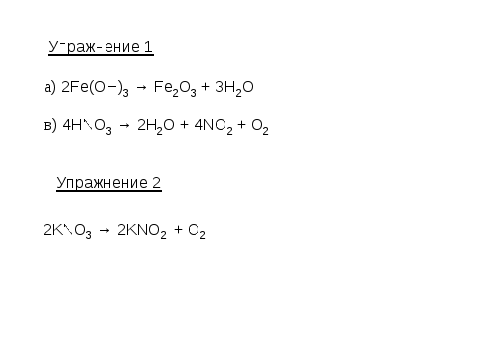
IV Рефлексия
Закончите следующие фразы:
я познакомился с ...
было непросто ...
я добился ...
у меня получилось ...
хотелось бы ...
мне запомнилось ...
я попробую ...
Слайд 14

V Домашнее задание
Слайд 15

§29, упр. 1 (б,г)
Упражнение 1
Запишите уравнения реакций разложения, схемы которых:
б) Ca3(PO4)2 → CaO + P2O5
г) Cu(NO3)2 → CuO + NO2 + O2
|
Беседа с классом, запись темы урока в тетрадь, записи на доске
Беседа с классом
Приём «Древо предсказаний»
Приложение 1
Запись уравнений реакций в тетрадь, проверка;
Заполнение «Древа»
Подведение под понятие
Запись определения в тетрадь
Инструктаж по ТБ
Выполнение Л.О. и заполнение таблицы, пероксид водорода, оксид марганца (IV)
Приложение 2
Запись определения в тетрадь
Самостоятельное выполнение упражнений
Само – или взаимопроверка
Рефлексия
Приложение 3
|
Приложение 1


Приложение 2
Ход выполнения
1
|
Наблюдение
|
Ход выполнения 2
|
Наблюдение
|
Вывод
|
Налить в пробирку пероксид водорода;
Нагреть, не доводя до кипения;
Внести тлеющую лучинку.
|
|
Налить в химический стакан на 1/3 пероксида водорода;
Аккуратно всыпать немного порошка оксида марганца (IV);
Внести в верхнюю часть стакана тлеющую лучинку
|
|
|
Приложение 3
Закончите следующие фразы:
я познакомился с ...
было непросто ...
я добился ...
у меня получилось ...
хотелось бы ...
мне запомнилось ...
я попробую ... |
|
|






 Скачать
Скачать
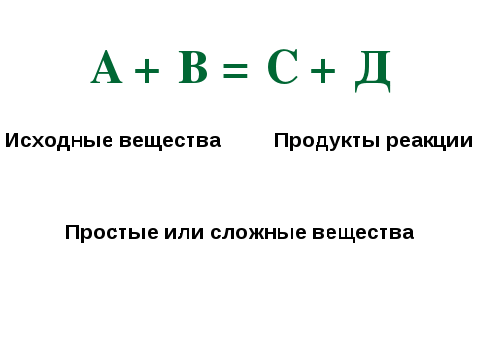




 Прогноз Т Прогноз
Прогноз Т Прогноз Е Аргументы
Е Аргументы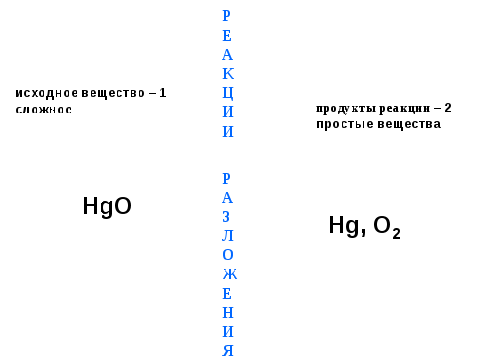
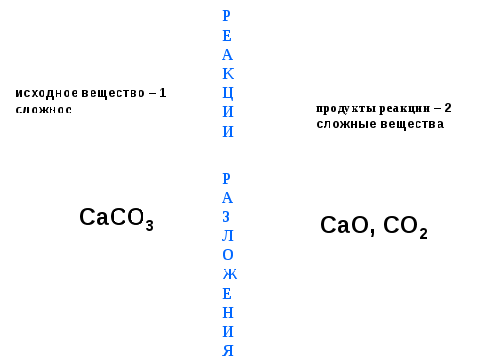
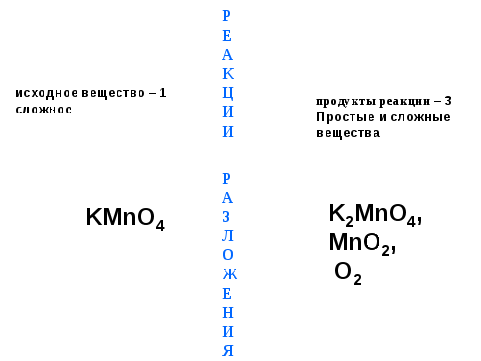


 продукты реакции - 2
продукты реакции - 2
 сложное Е
сложное Е Hg, О2 продукты реакции
Hg, О2 продукты реакции
 2
2
 СаО, СО2
СаО, СО2 продукты
продукты реакции
реакции