| Gs-best.ru Щебень плитка на могилу gs-best.ru. gs-best.ru |
Школьный этап Всероссийской олимпиады школьников по химии 9 класс Решите задачи. Задание 1
 Скачать 54.69 Kb. Скачать 54.69 Kb.
|
| Школьный этап Всероссийской олимпиады школьников по химии 9 класс Решите задачи. Задание 1. Вещество, полученное при сжигании 24 г кальция в кислороде, растворили в 164,25 г раствора соляной кислоты, содержащего 20% хлороводорода. Раствор выпарили и прокалили. Определите состав и массу сухого остатка. (20 баллов) Задание 2. При сливании двух неизвестных растворов получен раствор, содержащий только ионы Na+ и Cl–. Подберите примеры пяти пар исходных веществ, необходимых для получения такого раствора. Запишите уравнения реакций в молекулярном и ионном виде. (20 баллов) Задача 3. При нормальных условиях в одном объеме воды плотностью 1000 г/л растворяется 500 объемов хлороводорода. Рассчитайте массовую долю хлороводорода в таком растворе. (25 баллов) Задание № 4. Один из элементов периодической системы химических элементов Д.И. Менделеева образует оксид, массовая доля кислорода в котором составляет 30,5 %. Элемент проявляет в этом оксиде степень окисления, равную +4. Определите относительную атомную массу этого элемента и назовите его. (5 баллов) Задание №5. Напишите уравнения реакций, соответствующие следующим превращениям (А, Б, В — соединения меди): 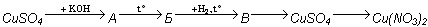 В переходах: Б→В и В→CuSO4 определите восстановитель и окислитель (20 баллов) Сумма баллов – 90 (100%). Ответы. Задание 1. Вещество, полученное при сжигании 24 г кальция в кислороде, растворили в 164,25 г раствора соляной кислоты, содержащего 20% хлороводорода. Раствор выпарили и прокалили. Определите состав и массу сухого остатка. Решение
Задание 2. При сливании двух неизвестных растворов получен раствор, содержащий только ионы Na+ и Cl–. Подберите примеры пяти пар исходных веществ, необходимых для получения такого раствора. Запишите уравнения реакций в молекулярном и ионном виде. Решение
Задание 3 При нормальных условиях в одном объеме воды плотностью 1000 г/л растворяется 500 объемов хлороводорода. Рассчитайте массовую долю хлороводорода в таком растворе. Решение
Задание 4. Один из элементов периодической системы химических элементов Д.И. Менделеева образует оксид, массовая доля кислорода в котором составляет 30,5 %. Элемент проявляет в этом оксиде степень окисления, равную +4. Определите относительную атомную массу этого элемента и назовите его. Решение
Задание №5. Напишите уравнения реакций, соответствующие следующим превращениям (А, Б, В — соединения меди): 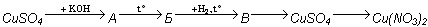 В переходах: Б→В и В→CuSO4 определите восстановитель и окислитель Решение
|