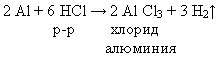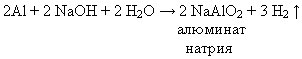Урок химии в 9 классе по теме: "Алюминий: химический элемент и простое вещество"
 Скачать 114.96 Kb. Скачать 114.96 Kb.
|
| Урок химии в 9 классе по теме: "Алюминий: химический элемент и простое вещество" Урок № 14 в теме “Металлы”, по учебнику О.С. Габриеляна “Химия, 9 класс”, составлен в соответствии с образовательной программой с использованием субъектного опыта учащихся. Цель урока: изучить особенности строения атома алюминия, а также физические и химические свойства простого вещества. Задачи урока: Образовательные: изучение особенностей атома алюминия, его физических и химических свойств, развитие представления о переходных химических элементах, Воспитательные: воспитание культуры работы с химическим оборудованием и реактивами, Развивающие: развитие умения и навыка самостоятельной и групповой деятельности; Основные понятия: химический знак “Аl”, химический элемент, простое вещество, электронная оболочка, степень окисления, переходный элемент, амфотерные свойства соединения. Оборудование: Периодическая система химических элементов Д.И.Менделеева, коллекция “Алюминий и его сплавы”, алюминий: фольга, проволока, порошок, растворы соляной кислоты и гидроксида натрия. Тип урока: изучение нового материала ХОД УРОКА І. Организационный момент. ІІ. Изучение нового материала. 1. Погружение в тему урока. Учитель: - Мы продолжаем изучение большой и важной темы “Металлы”. Сегодня нам предстоит познакомиться с металлом хорошо знакомым вам с детства. Историю открытия этого металла можно озаглавить как «Серебро из глины». “Однажды к римскому императору Тиберию пришёл незнакомец. В дар императору он принёс изготовленную им чашу из блестящего, как серебро, но чрезвычайно лёгкого металла. Мастер поведал, что получил этот металл из “глинистой земли”. Но император, боясь, что обесценятся его золото и серебро, велел отрубить мастеру голову, а его мастерскую разрушить”. Только в 1827 году нем. химик Ф. Вёлер получил новый металл. На эти эксперименты ему понадобилось 18 лет! К тому времени металл успел стать популярным, но, поскольку его получали в мизерных количествах, цены на него превышали цены на золото! О каком металле идёт речь? (Ответ: об алюминии) Учитель: - Таким образом, тема нашего урока: “Алюминий – химический элемент и простое вещество”. Запишите тему в тетради. Цель урока - изучить особенности строения атома алюминия, а также физические и химические свойства простого вещества. 2. Актуализация и обогащение субъективного опыта учащихся. Учитель: - С чего мы начинаем изучение химического элемента? Учащийся: - С характеристики его положения в Периодической системе Д.И.Менделеева. Учитель: - итак, дайте характеристику химического элемента алюминия, используя следующий план
Кратко запишите характеристику элемента в тетради:
Рефлексия этапа работы. После выполнения задания в классе разворачивается коллективное обсуждение по следующим вопросам учителя: 1. Сколько электронов находится на внешнем энергетическом уровне атома алюминия? Ответ: три электрона. 2. Какую степень окисления проявляет алюминий в сложных веществах? Ответ: +3 3. Алюминий будет отдавать или принимать электроны? Какие свойства он при этом проявляет? Ответ: отдавать электроны, проявляет восстановительные свойства. Значит алюминий это… Ответ: металл. Какой же это металл: активный или неактивный? Ответы могут быть разные: из своего жизненного опыта ребята отвечают, что это неактивный металл (алюминиевые провода не реагируют с водой), другие делают предположение об активности алюминия, так как он находится в электрохимическом ряду напряжения металлов сразу после активных металлов. Учитель: - Для решения вопроса об активности алюминия, что мы должны рассмотреть? Учащийся: - Физические и химические свойства алюминия, как простого вещества. Учитель: - Используя свои наблюдения, жизненный опыт перечислите физические свойства алюминия и область его применения. Заполните таблицу. Характеристика физических свойств алюминия и область его применения Таблица. Физические свойства алюминия и область их применения
Учитель: - Смогли ли мы, рассмотрев физические свойства алюминия, ответить на вопрос об его активности? Учащийся: - Нет. Учитель: - Рассмотрим химические свойства алюминия. - Посмотрим, как ведёт себя алюминий по отношению к простым веществам Учитель демонстрирует «Взаимодействие алюминия с простыми веществами: йодом, серой и кислородом». Опыт 1. Взаимодействие алюминия с йодом. Предварительно готовят смесь порошка алюминия с йодом (в массовых соотношениях 1:15). Данную смесь помещают в фарфоровую чашку горкой. Из пипетки на середину смеси капают несколько капель воды. Происходит бурная химическая реакция. Наблюдают выделение фиолетовых паров йода и горение металла. Опыт 2. Взаимодействие алюминия с серой. Смешивают размельченную серу и порошок алюминия в соотношениях 1:1. Смесь поместить в фарфоровую чашку или асбестовую сетку. Горящей лучинкой поджечь смесь. Наблюдаем реакцию. Опыт 3. Горение алюминия. Порошок алюминия помещаем в ложечку для сжигания веществ. Сверху кладём кусочек магниевой ленты или в её отсутствии 2–3 спичечные головки. Поджигаем. После начала горения, ложечку вносим в колбу с предварительно набранным кислородом. Наблюдаем яркое ослепительное пламя. Учитель: - где можно наблюдать подобное явление? Ответ: при горение бенгальских огней. Учитель: - При каких условиях алюминий реагировал с простыми веществами? Учащийся: - При использовании дополнительной энергии или катализатора (Н2О). Учитель: - Какой вывод можно сделать об активности алюминия? Учащийся: - Вывод: алюминий – активный металл. После демонстрации учащимся предлагается выполнить задание по выяснению отношения алюминия к простым веществам. Задание в тетрадях (Групповая работа) Характеристика химических свойств алюминия Цель: выяснить отношение алюминия к простым веществам – йоду, сере, кислороду, как восстановителя. Учитель: - 1. Напишите уравнения реакций, происходящих между алюминием и йодом, алюминием и кислородом. 2. Укажите окислитель и восстановитель. 3. Сделайте вывод о химической активности алюминия по отношению к простым веществам. 4. Проверьте друг у друга правильность записей по образцу. 5* Если вы затрудняетесь в написании окислительно-восстановительной реакции, пользуйтесь алгоритмом.
Образец выполнения задания в тетради
Учитель: - Посмотрим, как ведёт себя алюминий по отношению к сложным веществам: к воде, кислотам, щелочам, к оксидам тяжёлых металлов? А) Отношение к воде Учитель: - При комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой оксидной плёнкой, которая и защищает металл от внешних воздействий. Именно из-за наличия оксидной плёнки на поверхности алюминий не способен реагировать ни с водой, ни с концентрированными серной и азотной кислотами. Поэтому эти кислоты перевозят в алюминиевых цистернах. А теперь посмотрите на экран. Демонстрация видеофрагмента. В9-47 Учитель: - Итак, из видеозаписи видно, что алюминий всё таки взаимодействует с водой. Чем это можно объяснить? Ученики: - Взаимодействие возможно после удаления с поверхности алюминия оксидной плёнки. Учитель: - Какие продукты реакции при этом образуются? Запишите уравнения реакции взаимодействия алюминия с водой.
Б) Отношение к кислотам и щелочам Рассмотрим отношение алюминия к растворам кислоты и щелочи. Выполнение лабораторных опытов 1. «Взаимодействие алюминия с раствором соляной кислоты», 2. «Взаимодействие алюминия с раствором гидроксида натрия». Инструкция по выполнению лабораторной работы Цель: Изучить отношение алюминия к кислотам и щелочам. Правила работы с кислотами и щелочами: Соблюдайте осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промойте водой! При нагревании, прогрейте сначала всю пробирку. Опыт 1. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора соляной кислоты. Пробирку слегка нагрейте. Опыт 2. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора гидроксида натрия. Пробирку слегка прогрейте. Задание: 1. Выполните опыты; 2. Обговорите с соседом по парте, что наблюдали; 3. Запишите уравнения реакций; 4. Сделайте выводы. 5.* Если затрудняетесь записать уравнения реакций, откройте стр. 58-59 учебника. Фронтальная проверка. Комментированное чтение. При этом виде работы учащиеся получают возможность участвовать в самопроверке знаний и умений, совершенствуют свою речь, обращают внимание на правильное употребление химических терминов и названий веществ.
В) Отношение к оксидам тяжёлых металлов Учитель: Алюминий широко используют в металлургии для получения металлов – хрома, марганца, ванадия, титана, циркония из их оксидов. Этот способ получения металлов носит название алюминотермия. На практике часто используется смесь Fe3O4 (железной окалины) с порошком алюминия. Если эту смесь поджечь с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты. Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, именно поэтому процесс используют для сварки стальных изделий. Демонстрация видеоролика «Взаимодействие алюминия с оксидом железа (III)» Учитель: Запишите уравнение химической реакции взаимодействия алюминия с оксидом железа (III) и разберите его методом электронного баланса самостоятельно.
Учитель: - давайте сделаем вывод о химической активности алюминия. Учащиеся: - Алюминий - довольно активный металл, который может взаимодействовать с простыми веществами (кислородом , галогенами, серой), со сложными веществами (с водой, с кислотами, со щелочами, с оксидами металлов). Способность взаимодействовать и с кислотами, и со щелочами объясняет его амфотерные свойства. ІІІ. Закрепление изученного материала.
Найдите выигрышный путь, состоящий из формул веществ, способных взаимодействовать с алюминием.
V. Домашнее задание. § 13 до стр.60. |